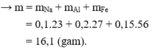Hòa tan m (g) hỗn hợp X gồm Mg, Al vào HNO3 đặc nguội , dư thu đc 0,336 lít NO2 ở 0 độ C, 2atm. Cũng m (g) hỗn hợp X trên hòa tan trong HNO3 loãng dư thì thu đc 0,168 lít NO ở O độ C và 4atm. Giá trị của m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Al không tác dụng với $HNO_3$ đặc nguội
$Cu + 4HNO_3 \to Cu(NO_3)_2 + 2NO_2 + 2H_2O$
$n_{Cu} = \dfrac{1}{2}n_{NO_2} = \dfrac{1}{2}.\dfrac{3,36}{22,4} = 0,075(mol)$
Mặt khác : $n_{NO} = \dfrac{7,84}{22,4} = 0,35(mol)$
Bảo toàn electron : $2n_{Cu} + 3n_{Al} = 3n_{NO}$
$\Rightarrow n_{Al} = \dfrac{0,35.3 - 0,075.2}{3} = 0,3(mol)$
$m = 0,075.64 + 0,3.27 = 12,9(gam)$

Đáp án C
Khi cho X vào H2O thì thu được 0,4 mol H2 còn khi cho vào NaOH thì thu được 0,55 mol H2 chứng tỏ khi cho vào H2O thì NaOH dư.
Gọi số mol Na và Al lần lượt là a, b
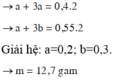

Đáp án D
Nhiệt phân thấy mhh X giảm 1,44g ⇒ mH2O tách từ bazo = 1,44g.
⇒ Quy hỗn hợp X gồm: mX = mKim loại + mO + mH2O.
Phản ứng với HCl: Đặt nO/X = a ta có:
2a + 2nH2 = nHCl ⇔ nO/X = 0,58 mol.
⇒ mKim loại trong X = m – mO – mH2O = m – 10,72 gam.
●Phản ứng với HNO3 có thể sinh ra muối NH4NO3:
Đặt nNH4NO3 = b ta có:
mMuối = m + 108,48 = mKim loại + mNO3–/Muối kim loại + mNH4NO3.
⇔ m + 108,48 + (m – 10,72) + (2nO + 3nNO + 8nNH4NO3)×62 + 80b.
⇔ m + 108,48 + (m – 10,72) + (0,58×2 + 0,2×3 + 8b)×62 + 80b ⇔ b = 0,0175 mol.
⇒ ∑nHNO3 đã pứ = 10nNH4NO3 + 4nNO + 2nO = 2,135 mol

Ta có: \(n_{NO}+n_{NO_2}+n_{N_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\left(1\right)\)
Mà: mX = 35,8 (g)
\(\Rightarrow30n_{NO}+46n_{NO_2}+28n_{N_2}=35,8\left(2\right)\)
Có: \(n_{Al}=\dfrac{32,4}{27}=1,2\left(mol\right)\)
\(n_{Cu}=\dfrac{22,4}{64}=0,35\left(mol\right)\)
BT e, có: 3nNO + nNO2 + 10nN2 = 3nAl + 2nCu = 4,3 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,3\left(mol\right)\\n_{NO_2}=0,4\left(mol\right)\\n_{N_2}=0,3\left(mol\right)\end{matrix}\right.\)
⇒ nHNO3 = 4nNO + 2nNO2 + 12nN2 = 5,6 (mol)