1.Cho 4.6 gam Na tác dụng với 200 gam dung dịch HCl 2.92%.Tính nồng độ phần trăm của mỗi chất có trong dung dịch thu được
2. Oxi hóa 8 lít khí SO2 (đktc) thu được sản phẩm cho hòa tan vào 57.2 ml dung dịch H2SO4 60%, khối lượng riêng 1.5 g/ml. TÍnh C% của dung dịch Axit thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1 , \(n_{Na}=\frac{4,6}{23}=0,2\left(mol\right)\)
\(m_{HCl}=200.2,92\%=5,84\left(mol\right)\) => \(n_{HCl}=\frac{5,84}{36,5}=0,16\left(mol\right)\)
\(2Na+2HCl->2NaCl+H_2\left(1\right)\)
vì \(\frac{0,2}{2}>\frac{0,16}{2}\) => Na dư , HCl hết
dung dịch thu được là dung dịch NaCl
theo (1) \(n_{NaCl}=n_{HCl}=0,16\left(mol\right)\) => \(m_{NaCl}=0,16.58,5=9,36\left(g\right)\)
\(n_{H_2}=\frac{1}{2}n_{HCl}=0,08\left(mol\right)\)
khối lượng dung dịch sau phản ứng là
4,6+200-0,08.2=204,44(g)
\(C_{\%\left(NaCl\right)}=\frac{9,36}{204,44}.100\%\approx4,58\%\)

\(BTNT\left(S\right):n_{SO3}=n_{SO2}=\dfrac{V}{22,4}=\dfrac{5}{14}\left(mol\right)\)
Ta có : \(n_{H2SO4}=\dfrac{9}{25}\left(mol\right)\)
\(\Rightarrow\Sigma n_{H2SO4}=\dfrac{5}{14}+\dfrac{9}{25}=\dfrac{251}{350}\left(mol\right)\)
\(\Rightarrow C\%=\dfrac{m_{H2SO4}}{m_{dd}}.100\%=64,7\%\)

Ta có: \(n_{SO_2}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\)
BTNT S, có: nH2SO4 = nSO3 = nSO2 = 0,5 (mol)
Mà: mH2SO4 (ban đầu) = 210.10% = 21 (g)
⇒ mH2SO4 (trong X) = 21 + 0,5.98 = 70 (g)
Có: m dd X = 210 + mSO3 = 210 + 0,5.80 = 250 (g)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{70}{250}.100\%=28\%\)

Chọn B
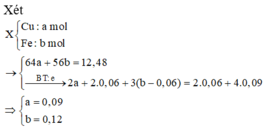
Khi cho X tác dụng với HNO3 thu được dung dịch T gồm Fe(NO3)2 (x); Fe(NO3)3 (y); Cu(NO3)2 (0,09).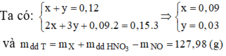
Vậy C% Fe(NO3)3 = 5,67%

a)
$2K + 2H_2O \to 2KOH + H_2$
$BaO + H_2O \to Ba(OH)_2$
Theo PTHH :
$n_K = 2n_{H_2} = 0,2(mol)$
$\%m_K = \dfrac{0,2.39}{23,1}.100\% = 33,77\%$
$\%m_{BaO} = 100\%- 33,77\% = 66,23\%$
b)
$n_{BaO} = \dfrac{23,1 - 0,2.39}{153} = 0,1(mol)$
$m_{dd} = 23,1 + 177,1 - 0,1.2 = 200(gam)$
$C\%_{KOH} = \dfrac{0,2.56}{200}.100\% = 5,6\%$
$C\%_{Ba(OH)_2} = \dfrac{0,1.171}{200}.100\% = 8,55\%$
c)
$KOH + HCl \to KCl + H_2O$
$Ba(OH)_2 + 2HCl \to BaCl_2 + 2H_2O$
$n_{HCl} = 2n_{Ba(OH)_2} + n_{KOH} = 0,4(mol)$
$V = \dfrac{0,4}{0,5} = 0,8(lít) = 800(ml)$

+ Tính được những gì có thể tính được
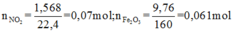
+ Với bài toán gồm nhiều giai đoạn liên tiếp nhau như thế này ta nên tóm tắt lại bài toán:
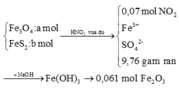
Bây giờ ta phải thiết lập được mối quan hệ giữa a và b với hi vọng là tìm được a và b rồi sau đó áp dụng các định luật bảo toàn như khối lượng, nguyên tố, electron ....
+ Bảo toàn nguyên tố Fe: 3a + b = nFe = 2.0,061 = 0,122
+ Bảo toàn sốmol electron trao đổi: a + 15b = 0,07.1 ( Chú ý FeS2→Fe3+ + 2S+6 + 15e)
Giải được a = 0,04; b = 0,002.
+ Tiếp tục sử dụng bảo toàn nguyên tố S:
![]()
+ Vì phản ứng xảy ra hoàn toàn và vừa đủ nên sau khi phản ứng với dung dịch NaOH ta chỉ thu được 2 muối là Na2SO4 và NaNO3.
Áp dụng định luật bảo toàn nguyên tố Na:
![]()
+ Cuối cùng dựa vào sơ đồ tóm tắt, ta sẽ dùng bảo toàn nguyên tố N
![]()
=>![]()
Đáp án D
