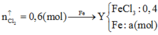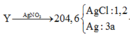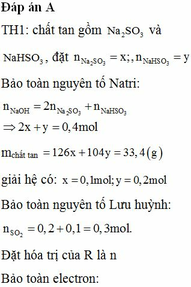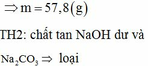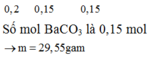hòa tan hoàn toàn 5,94g Al vào dung dịch NaOH dư được khí thứ nhất. Cho 1.896g KMnO4 tác dụng với HCl dư được khí thứ hai. Nhiệt phân hoàn toàn12.25g KClO3 được khí thứ ba. Cho toàn bộ các khí ở trên vào một bình kín rồi đốn cháy để các phản ứng xẩy ra hoàn toàn. Sau đó làm lạnh bình để nước ngưng tụ hết và giả thiết các chất tan hết trong nước thu được dung dịch E. Viết các phương trình phản ứng xẩy ra và tính nồng độ % của E.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các phản ứng xảy ra:
Al + NaOH + H2O = NaAlO2 + 3/2H2 (1)
0,22 0,33 mol
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 8H2O + 5Cl2 (2)
0,012 0,03 mol
KClO3 = KCl + 3/2O2 (3)
0,1 0,15 mol
Như vậy, 3 khí X, Y, Z tương ứng là: H2 (0,33 mol), Cl2 (0,03 mol) và O2 (0,15 mol).
H2 + Cl2 = 2HCl (4) 2H2 + O2 = 2H2O (5)
0,03 0,03 0,06 mol 0,3 0,15 0,3 mol
Theo phản ứng (4) và (5) thì các khí đã phản ứng vừa đủ với nhau, do đó dd A thu được là dung dịch của HCl.
Do đó: C% = 36,5.0,06.100/(36,5.0,06 + 18.0,3) = 80,22%

Giải thích:
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
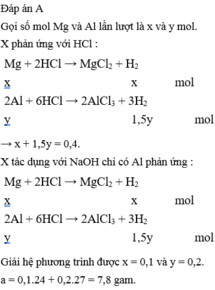
Đáp án A

Đáp án : A
+) HCl : Al -> 1,5H2
Mg -> H2
+) NaOH : Al -> 1,5H2
=> nAl = 2/3 nH2 = 0,2 mol
=> nMg = nH2(1) – nH2(Al) = 0,4 – 0,3 = 0,1 mol
=> %mAl = 69,23%

\(n_{KMnO_4}=0,1\left(mol\right)\)
\(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(\Rightarrow n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
Bảo toàn e:\(\Rightarrow2a+3b=0,5\)
Mặt khác: \(64a+56b=13,6-0,05.32=12\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1.56}{12}.100\%=46,67\left(\%\right)\)
Tại sao lại có 2a+3b=0,5 ạ ?
Qúa trình nhường e của Fe diễn ra ntn ạ ?