1 nguyên tử X có 3 đồng vị. A1=24 chiếm 78,6%. A2=25 chiếm 10%. A3=26 chiếm 11,4%. Mỗi khi có 50 nguyên tử X, A=25 thì có bao nhiêu nguyên tử các đồng vị còn lại?
Giải dùm mình cụ thể nha..cảm ơn nhiều ạ !
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Gọi số khối của X lần lượt là A1, A2, A3
Ta có hệ
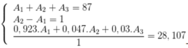
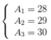

a.
X + 2HCl = XCl2 + H2
nX = nH2 = 5,6/22,4 = 0,25 mol
=> X = 6,082/0,25 = 24,328 (Mg)
b.
Mg có Z = 12
Gọi A1, A2, A3 lần lượt là số khối của 3 đồng vị
Tổng số khối của 3 đồng vị là 75
=> A1 + A2 + A3 = 75 (1)
Số khối của đồng vị thứ hai bằng trung bình cộng số khối của hai đồng vị kia
A2 = (A1 + A3)/2 => A1 - 2A2 + A3 = 0 (2)
Lấy (1) trừ (2) => 3A2 = 75 => A2 = 25 => N2 = A2 - Z = 25 - 12 = 13
Đồng vị thứ 3 có số neutron nhiều hơn đồng vị thứ 2 là 1 đơn vị
N3 - N2 = 1 => N3 = 1 + 13 = 14
=> A3 = 12 + 14 = 26
=> A1 = 75 - 26 - 25 = 24
Đồng vị 26Mg trong tự nhiên chiếm 11,4% số nguyên tử
=> %(24Mg, 25Mg) = 100% - 11,4% = 88,6%
Ta có : (88,6 - x)A1 + xA2 + 11,4A3 = 24,328.100
=> x = 10(%)
Vậy thành phần % của 3 đồng vị 24Mg, 25Mg và 26Mg lần lượt là
78,6%, 10% và 11,4%
c.
Giả sử có 100 nguyên tử Mg thì sẽ có
78,6 nguyên tử 24Mg ; 10 nguyên tử 25Mg ; 11,4 nguyên tử 26Mg
Vậy nếu có 50 nguyên tử 25Mg thì sẽ có
393 nguyên tử 24Mg và 57 nguyên tử 26Mg

Phần trăm đồng vị thứ nhất \(^{24}Mg\) là 78,6%.
Gọi phần trăm đồng vị \(^{25}Mg\) và \(^{26}Mg\) lần lượt là a và b.
\(\Rightarrow\left\{{}\begin{matrix}78,6\%+a\%+b\%=100\%\\24\cdot78,6\%+25\cdot a\%+26\cdot b\%=24,327\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=10,1\%\\b=11,3\%\end{matrix}\right.\)

Đặt x nguyên tử khối của đồng vị còn lại
Ta có : \(\overline{M}=\dfrac{54,5.79+\left(100-54,5\right).x}{100}=79,91\)
\(\rightarrow x=81\)
Vậy nguyên tử khối của đồng vị còn lại : \(^{81}X\)