Tính số nguyên tử hiđr có trong 1g hiđro,số nguyên tử oxi có trong 32g oxi
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{H_2O}=D\cdot V=36\cdot1=36\left(g\right)\)
\(n_{H_2O}=\dfrac{36}{18}=2\left(mol\right)\)
\(n_O=2\left(mol\right)\)
\(m_O=2\cdot16=32\left(g\right)\)
Số phân tử H2O : \(2\cdot6\cdot10^{23}=12\cdot10^{23}\left(pt\right)\)
Số nguyên tử H : \(4\cdot6\cdot10^{23}=24\cdot10^{23}\left(nt\right)\)

Đáp án C
Gọi x là phần trăm nguyên tử của đồng vị H 1 2 ta có:
2 x + 1 ( 1 - x ) = 1 , 008 ⇒ x = 0 , 008
d = 1 g / m l ⇒ m H 2 O = 1 ⇒ n H 2 O = 1 18 ⇒ n H = 1 9 m o l
1 mol H chứa 0,008.6,02.1023 đồng vị H 1 2
⇒ 1 9 mol chứa 0 , 008 . 6 , 02 . 10 23 9 = 5 , 35 . 10 20

Fe2(SO4)3 chứ
Sao không rút gọn Fe2(SO3)4 thành Fe(SO3)2 đi với cả sắt ko hóa trị IV

Cứ 1 nguyên tử H có khối lượng 1,66.10-24g.
Số nguyên tử H có 1 g hidro bằng:
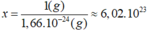

Tổng số oxi hoá của hiđro và của oxi trong phân tử H 2 O bằng không .
2×(+1)+(-2) = 0

Coi $n_{H_2O} = 1(mol)$
Suy ra : $n_H = 2(mol)$
$\Rightarrow n_O = 2.0,875 = 1,75(mol)$
Ta có : $n_O = 4n_{H_2SO_4} + n_{H_2O}$
$\Rightarrow n_{H_2SO_4} = 0,1875(mol)$
$m_{dd} = m_{H_2SO_4} + m_{H_2O} = 0,1875.98 + 1.18 = 36,375(gam)$
$C\%_{H_2SO_4} = \dfrac{0,1875.98}{36,375}.100\% = 50,5\%$
NTKH = 1 (đvC)
=> KHỐI LƯỢNG BẰNG g CỦA 1 NGUYÊN TỬ HIDRO LÀ:
1 * 1,66 *10-24 = 1,66 * 10-24 (g)
=> TRONG 1g HIDRO CÓ SỐ NGUYÊN TỬ HIDRO LÀ :
1/(1,66 * 10-24) = 6,02 * 1023 ( NGUYÊN TỬ)
NTKO = 16 (đvC)
=> KHỐI LƯỢNG BẰNG g CỦA 1 NGUYÊN TỬ OXI LÀ:
16 * 1,66*10-24 = 2,66*10-23 (g)
TRONG 32g OXI CÓ SỐ NGUYÊN TỬ OXI LÀ :
32/(2,66*10-23) = 1,2 * 1024 (NGUYÊN TỬ)