để có 5,6 lít khí O2(dktc) để làm thí nghiệm. theo em cần phải lấy khối lượng kali pemanganat KMnO4 bao nhiêu? biết hiệu suất phản ứng là 96 phần trăm.
Giúp mình nha, sáng chủ nhật là mình nộp bài rùi, mình xin cảm tạ!![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Thể tích khí oxi cần thu là: 20*100 = 2000(ml) = 2(l).
Vì hao hụt 10% nên thể tích khí oxi cần có là: 100*2/90 = 20/9 (l).
Số mol khí oxi là: 20/(22,4*9) = 0,099 (mol)
2KMnO4 => K2MnO4 + MnO2 + O2
Số mol KMnO4 là: 0,099 * 2 = 0,2 (mol)
Khối lượng KMnO4 là: 0,2*158 = 31,3 (g)
b, 2KClO3 => 2KCl + 3O2
Số mol KClO3 là: 0,099*2/3 = 0,066 (mol).
Khối lượng cần dùng là: 0,066*122,5 = 8,085 (g)
2 PTPU trên đều có nhiệt độ

2KMnO4 \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2
nO2 cần điều chế = 67,2 : 22,4 = 3 mol
=> nKMnO4 cần dùng = 2nO2 = 6 mol
Nhưng hiệu suất phản ứng chỉ đạt 80% nên nKMnO4 thực tế cần dùng là 6:80% = 7,5 mol
<=> mKMnO4 = 7,5.158 = 1185 gam = 1,185 kg

Theo định luật bảo toàn khối lượng ta có: m O 2 = 15,8 – 12,6 = 3,2(g)
Hiệu suất của phản ứng phân hủy: H = 2,8/3,2 x 100 = 87,5%

a) Do khí oxi thu được hao hụt 10% nên hiệu suất phản ứng là 90%.
Thể tích khí oxi thu được là:
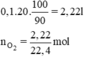
Phương trình hóa học của phản ứng nhiệt phân KMnO4:
2KMnO4 -to→ O2 + K2MnO4 + MnO2.
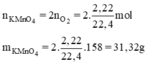
b) Ý b) tách biệt so với ý a), ngoài ra ở ý b) không cho lượng oxi hao hụt là bao nhiêu nên ta lấy hiệu suất phản ứng đạt 100%.
Thể tích khí oxi thu được là: V = 0,1.20 = 2 (lít)


a) nS = \(\frac{m}{M}=\frac{3,2}{32}=0,1\)mol
PTHH oxi với lưu huỳnh
O2 + S -----> SO2
1 : 1 : 1
0,1 0,1 0,1
mol mol mol
=> mO2 = n.M = 0,1.32 = 3,2 g
Sô mol oxi ban đầu :
nO2 = \(\frac{V}{22,4}=\frac{5,6}{22,4}=0,25\)
=> mO2 lúc đầu = 0,25 x 32 = 8 g
=> mO2 còn lại = 8 - 3,2 = 4,8 g
=> nO2 lúc này = \(\frac{m}{M}=\frac{4,8}{32}=0,15\)
PTHH với oxi với cacbon
O2 + C ----> CO2
1 : 1 : 1
0,15 0,15 : 0,15
mol mol mol
=> mC = 0,15.28 = 7 g
b) nO2 = \(\frac{V}{22,4}=\frac{5,6}{22,4}=0,25\)
PTHH phản ứng + cân bằng
2KMnO4 ----> K2MnO4 + MnO2 + O2
2 : 1 : 1 : 1
0,5 mol 0,25 mol
=> mKMnO4 = n.M = 0,5.158 = 79 g

a, Thể tích khí oxi cần thu là: 20*100 = 2000(ml) = 2(l).
Vì hao hụt 10% nên thể tích khí oxi cần có là: 100*2/90 = 20/9 (l).
Số mol khí oxi là: 20/(22,4*9) = 0,099 (mol)
2KMnO4 => K2MnO4 + MnO2 + O2
Số mol KMnO4 là: 0,099 * 2 = 0,2 (mol)
Khối lượng KMnO4 là: 0,2*158 = 31,3 (g)
b, 2KClO3 => 2KCl + 3O2
Số mol KClO3 là: 0,099*2/3 = 0,066 (mol).
Khối lượng cần dùng là: 0,066*122,5 = 8,085 (g)
Hihi

a) V O2 cần dùng= 20 . 100=2000 ml=2 (l)
--> n O2 =\(\frac{2}{22,4}\)=\(\frac{5}{56}\)(mol)
2KMnO4 --t*--> K2MnO4 + MnO2 + O2
\(\frac{5}{28}\) <------- \(\frac{5}{56}\)(mol)
m KMnO4 = \(\frac{5}{28}\). 158 . (100% + 10%)= 31,04 (g)
b) 2KClO3 ----t*,V2O5----> 2KCl + 3O2 (nhiệt độ, xúc tác)
\(\frac{5}{84}\) <------- \(\frac{5}{56}\)(mol)
m KClO3=\(\frac{5}{84}\).122,5= 7,29(g)
a) Thể tích oxi cần dùng là : (lít).
Số mol khí oxi là : = 0,099 (mol).
Phương trình phản ứng :
2KMnO4 K2MnO4 + MnO2 + O2
2mol 1mol
n mol 0,099 mol
=> n = = 0,198 (mol).
Khối lượng Kali pemaganat cần dùng là :
m = 0,198. (39 + 55 + 64) = 31,3 (g).
b) Phương trình hóa học.
KClO3 2KCl + 3O2
2.122,5 gam 3.22,4 lít
m gam 2,22 lít
Khối lượng kali clorat cần dùng là :
m = (gam).

\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PTHH: \(n_{KClO_3}=\dfrac{0,25.2}{3}\approx0,17\left(mol\right)\)
Vậy muốn điều chế 5,6 lít O2 cần dùng số gam Kali clorat:
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=0,17.122,5=20,825g\)
\(n_{O2}\)=\(\dfrac{V}{22,4}\)=\(\dfrac{5,6}{22,4}\)=0,25 (mol)
PT : 2KClO3 →to 2KCl + 3O2
số mol: \(\dfrac{1}{6}\) ← \(\dfrac{1}{6}\) ← 0,25
⇒ mKClO3 = n . M = \(\dfrac{1}{6}\) . 122,5 ∼∼ 20,41(g)

\(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{1}{6}\left(mol\right)\Rightarrow m_{KClO_3}=\dfrac{1}{6}.122,5=\dfrac{245}{12}\left(g\right)\)
nO2=5.6:22.4=0.25(mol)
PTHH:2KMnO4->K2MnO4+MnO2+O2
Theo pthh:nK2MnO4=2nO2->nK2MnO4=0.5(mol)
mK2MnO4=0.5*197:96%=102.6(g)
thank bạn nha, những kết quả ra 80,6 g cơ