muốn pha chế 300ml dung dịch NaOH có pH=10 thì khối lượng NaOH cần dùng là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


* Phần tính toán:
Khối lượng dung dịch NaOH: m d d = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
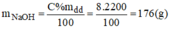
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ m d d = V.d = 1,05.x
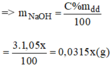
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ m d d = V.d = 1,12.y
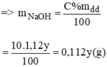
Ta có hệ phương trình sau: 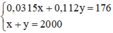
Giải hệ phương trình trên, ta được: 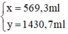
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.

Ta có: \(pH=14+log\left(OH^-\right)\) \(\Rightarrow log\left(OH^-\right)=-4\)
\(\Rightarrow\left[OH^-\right]=C_{M_{NaOH}}=0,0001\left(M\right)\)
\(\Rightarrow n_{NaOH}=0,0001\cdot0,25=2,5\cdot10^{-5}\left(mol\right)\)
\(\Rightarrow m_{NaOH}=2,5\cdot10^{-5}\cdot40=0,001\left(g\right)\)

Bài 10: Cho 5,6g CaO vào nước tạo thành dung dịch A. Tính số gam kết tủa tạo thành khi đem dung dịch A hấp thụ hoàn toàn 2,8 lít khí cacbonic.
---
nCaO= 5,6/56=0,1(mol)
nCO2=2,8/22,4=0,125(mol)
PTHH: CaO + H2O -> Ca(OH)2
Ca(OH)2 + CO2 -> CaCO3 + H2O (1)
x_______x_______x(mol)
Ca(OH)2 + 2 CO2 -> Ca(HCO3)2 (2)
y______2y_______y(mol)
Ta có: 1< 0,125/0,1=1,25<2
=> Sp thu được hỗn hợp 2 muối.
Đặt nCa(OH)2 (1) và nCa(OH)2 (2) là x và y (mol) (x,y>0)
Ta có hpt:
\(\left\{{}\begin{matrix}x+2y=0,125\\x+y=0,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,075\\y=0,025\end{matrix}\right.\)
=> m(kết tủa)= mCaCO3= 100x=100.0,075=7,5(g)
Chúc em học tốt!
Bài 7 :
300ml = 0,3l
Số mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1,5.0,3=0,45\left(mol\right)\)
Pt : H2SO4 + 2NaOH → Na2SO4 + 2H2O\(|\)
1 2 1 2
0,45 0,9
a) Số mol của natri hidroxit
nNaOH = \(\dfrac{0,45.2}{1}=0,9\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,9 . 40
= 36 (g)
Khối lượng của dung dịch natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{36.100}{40}=90\left(g\right)\)
b) Pt : H2SO4 + 2KOH → K2SO4 + 2H2O\(|\)
1 2 1 2
0,45 0,9
Số mol của kali hidroxit
nKOH = \(\dfrac{0,45.2}{1}=0,9\left(mol\right)\)
Khối lượng của kali hidroxit
mKOH = nKOH . MKOH
= 0,9 . 56
= 50,4 (g)
Khối lượng của dung dịch kali hidroxit C0/0KOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{30,4.100}{5,6}=542,86\) (g) Thể tích của dung dịch kali hidroxit cần dùng
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{542,86}{1,045}=519,48\left(ml\right)\)
Chúc bạn học tốt

a)$n_{H_2SO_4} = 0,3.1,5 = 0,45(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{NaOH} = 2n_{H_2SO_4} = 0,9(mol)$
$m_{dd\ NaOH} = \dfrac{0,9.40}{40\%} = 90(gam)$
b)
$n_{KOH} = n_{NaOH} = 0,9(mol0$
$m_{dd\ KOH} = \dfrac{0,9.56}{5,6\%} = 900(gam)$
$V_{dd\ KOH} = \dfrac{m}{D} = \dfrac{900}{1,045} = 861,24(ml)$

\(n_{NaOH}=0,2.2,5=0,5\left(mol\right)\\ m_{NaOH}=0,5.40=20g\\ m_{\text{dd}}=\dfrac{100.20}{40}=50g\)

Khi pH = 10 thì [H+] = 1.10-10M và
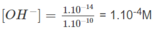
nghĩa là cần có 1. 10 - 4 mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có 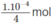 NaOH hoà tan, nghĩa là cần có
NaOH hoà tan, nghĩa là cần có
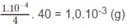 NaOH
NaOH

a)
m dd = 2 + 80 = 82(gam)
C% NaCl = 2/82 .100% = 2,44%
b) Coi V dd = 100(ml)
Ta có :
m dd = D.V = 1,08.100 = 108(gam)
n NaOH = 0,1.2 = 0,2(mol)
Suy ra : C% NaOH = 0,2.40/108 .100% = 7,41%
pH=10
=>pOH=4
=>[OH]=10^-4
=>[NaOH]=10^-4 M
=>nNaOH=3*10^-5
=>mNaOH=0,00069g
1,2*10^-3