Nhiệt phân m (gam) hỗn hợp rắn A chứa CaCO3; BaCO3 và MgCO3 thu được 76 gam hỗn hợp rắn B và 33,6 lít khí CO2 (đkc). Biết hiệu suất nhiệt phân cho toàn quá trình là 80%; xác định giá trị của m ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Na2CO3 bền với nhiệt nên không bị nhiệt phân.
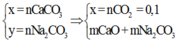
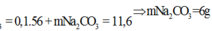
%mCaCO3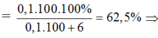
%mCaCO3 = Chọn D.

Đáp án D
nCO2= nCaCO3 = 0,15 mol
ð mCaCO3 = 15 gam
mX= mrắn + mCO2
= 17,4+ 0,15.44=24 gam
%mCaCO3= (15:24).100%=62,5%

Na2CO3 không bị nhiệt phân, nên 2,24 lít khí sinh ra chính là CO2 do CaCO3 bị nhiệt phân theo phản ứng
![]()
Cách 1:
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
m X = m c h ấ t r ắ n + m C O 2 = 11,6 + 0,1.44 = 16 (gam)
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
![]()
Cách 2:
Ta có:
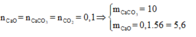
Hỗn hợp rắn thu được gồm CaO và Na2CO3
![]()
![]()
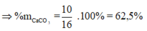
Đáp án D

Đáp án C
• Nhiệt phân hoàn toàn CaCO3, Na2CO3 được 11,6 gam chất rắn và 0,1 mol CO2![]()
nCO2 = 0,1 mol → nCaO = 0,1 mol → nCaO = 0,1 × 56 = 5,6 gam → mNa2CO3 = 11,6 - 5,6 = 6 gam; mCaCO3 = 0,1 × 100 = 10 gam
![]() → Đáp án đúng là đáp án C
→ Đáp án đúng là đáp án C

\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(CaCO_3\rightarrow\left(t^o\right)CaO+CO_2\)
0,1 0,1 0,1 ( mol )
\(m_{Na_2CO_3}=11,6-\left(0,1.56\right)=6g\)
\(m_{CaCO_3}=0,1.100=10g\)
\(\%m_{Na_2CO_3}=\dfrac{6}{10+6}.100=37,5\%\)

Giả sử có 100g đá
=> \(m_{CaCO_3}=\dfrac{100.80}{100}=80\left(g\right)\)
\(n_{CaCO_3}=\dfrac{80}{100}=0,8\left(mol\right)\)
Gọi số mol CaCO3 phân hủy
PTHH: CaCO3 --to--> CaO + CO2
a-------------->a--->a
=> mY = 100 - 44a (g)
=> mCaO = 56a (g)
=> \(\dfrac{56a}{100-44a}.100\%=45,65\%\)
=> a = 0,6 (mol)
=> \(H=\dfrac{0,6}{0,8}.100\%=75\%\)
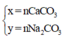
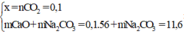
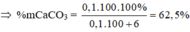
Bảo toàn khối lượng :
\(m_A=76+1.5\cdot44=142\left(g\right)\)
\(m_{A\left(bđ\right)}=\dfrac{142}{80\%}=177.5\left(g\right)\)