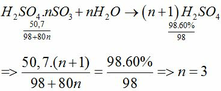Hòa tan 3,8 H2SO4.nSO3 vào H2O dư được ddA. Để trung hòa 1/10 dd A cần dùng 80ml dd NaOH 0,1M. Tìm ct của H2SO4.nSO3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


B2: gọi a, b lần lượt là nồng độ A, B
a) theo gt:
TH1: 0.3l B + 0.2 l A =>0.5 l C
do dd C có tính bazơ nên chúng tỏ khi trộn 0.3 l B với 0.2 l A sau phản ứng NaOH sẽ dư H2SO4 hết
H2SO4 + 2 NaOH --> Na2SO4 + H20
sô mol 0.2 * a --> 0.4 * a
trung hoá C = 0.04 l HCl 0.05M (0.002 mol)có pư:
HCl + NaOH --> NaCl + H2O
số mol 0.002 --> 0.002
theo bài ra trong 0.02 l dd C có 0.002 mol NaOH => trong 0.5 l dd C có 0.05 mol NaOH => ta có 0.3 *b - 0.4 * a = 0.05 (1)
TH2: 0.2 l B + 0.3 l A => 0.5 l D
do dd D có tính axit ( quy--> đỏ) nên chứng tỏ khi trộn 0.2 l B với 0.3 l A sau phản ứng NaOH sẽ hết H2SO4 dư
H2SO4 + NaOH --> Na2SO4 + H20
sô mol 0.2 * b <-- 0.2 * b
trung hoá D = 0.08 l NaOH 0.1M (0.008 mol)có pư:
H2SO4 + 2NaOH --> Na2SO4 + 2 H2O
số mol 0.004 --> 0.008
theo bài ra trong 0.02 l dd D có 0.004 mol H2SO4 => trong 0.5 l dd D có 0.1 mol H2SO4 => ta có 0.3 *a - 0.2 * b = 0.1 (2)
từ (1) và (2) => a=4 b= 5.5

gọi số mol của NaOH = x , Ba(OH)2 = y . số mol OH- = x + 2y
pt : H+ + OH- → H2O
nH+ =2. 0,035. 2=0,14 mol = x+ 2y
khối lượng kết tủa = mSO42- + mBa2+ = 96.0.07 + 137.y= 9,32 =>y=0,02 => x= 0,1
nồng độ tự tính.

đặt số mol oleum là x => số mol H2SO4 là \(\dfrac{89}{49}\)x
khối lượng dd sau phản ứng là x *178 + 200
theo bài ta có (\(\dfrac{89}{49}\)x * 98)/(x*178+200)=0,2 => x=0,28 mol
=> m H2SO4.SO3=0,28*178=49,84 g
bạn ơii, cho mình hỏi là tại sao số mol H2SO4 là 89/49x ạ?

H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé

a) \(n_{Na}=\dfrac{11,5}{23}=0,5\left(mol\right)\)
\(n_{NaOH}=\dfrac{8\%.500}{40}=1\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,5---------------->0,5------->0,25
\(\Sigma n_{NaOH}=0,5+1=1,5\left(mol\right)\)
\(m_{ddsaupu}=11,5+500-0,25.2=511\left(g\right)\)
=> \(C\%_{NaOH}=\dfrac{1,5.40}{511}.100=11,74\%\)
b) Gọi thể tích dung dịch X cần tìm là V
\(n_{H^+}=V.1+V.0,5.1=2V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
Ta có : \(n_{H^+}=n_{OH^-}=1,5\left(mol\right)\)
=> 2V=1,5
=> V=0,75(lít)