nung thủy ngân oxit thu được thủy ngân và oxi
viết PTHH và thuộc loại nào
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có : \(n_{HgO}=\frac{54,25}{217}=0,25\left(mol\right)\)
PTHH : \(2HgO\rightarrow2Hg+O_2\uparrow\)
Theo phương trình, ta có : \(n_{O_2}=\frac{1}{2}n_{HgO}\Rightarrow n_{O_2}=0,125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,125.22,4=2,8\left(l\right)\)

câu 1 một bình chứa 33,6 lít khí oxi (điều kiện tiêu chuẩn) với thể tích này có thể đốt cháy:
a) bao nhiêu game cacbon và tạo ra bao nhiêu lít cacbon dioxit
b) bao nhiêu gam lưu huỳnh và tạo ra bao nhiêu lít lưu huỳnh dioxit
c) bao nhiêu gam P và tạo ra bao nhiêu gam diphotpho pentaoxit

\(n_{Hg}=\dfrac{m}{M}=\dfrac{227}{2006}\left(mol\right)\)
\(PTHH:2Hg+O_2\rightarrow2HgO\)
\(.................\dfrac{227}{2006}.........\dfrac{227}{4012}............\dfrac{227}{2006}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{HgO}=n.M=~24,5\left(g\right)\\V_{O_2}=n.22,4=~1,27\left(l\right)\end{matrix}\right.\)
Vậy ...

nHgO = 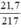 = 0,1 mol.
= 0,1 mol.
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.

2HgO -t--> 2Hg + O2
0,15-------------->0,75 (mol)
=> mO2 = 0,75 . 32 = 24 (g)

PTHH: HgO + \(H_2\) ---> Hg + \(H_2O\)
0,1 mol 0,1 mol 0,1 mol 0,1 mol
+ Số mol của HgO:
\(n_{HgO}\) = \(\dfrac{m}{M}\) = \(\dfrac{21,7}{217}\) = 0,1 (mol)
+ Số g thủy ngân (Hg) thu được:
\(m_{Hg}\) = n . M = 0,1 . 201 = 20,1 (g)
Vậy: thu được 20,1 g Hg (thủy ngân)
\(n_{HgO}=\dfrac{m_{HgO}}{M_{HgO}}=\dfrac{21,7}{217}=0,1\left(mol\right)\)
\(HgO+H_2\underrightarrow{t^0}H_2O+Hg\)
Theo PT: 1mol _ 1mol _ 1mol _ 1mol
Theo đề: 0,1 mol _ 0,1 mol _ 0,1 mol _ 0,1 mol
\(m_{Hg}=n_{Hg}.M_{Hg}=0,1.201=20,1\left(g\right)\)

HgO+H2-to>Hg+H2O
0,025-0,025--0,025
n HgO=\(\dfrac{8,68}{217}\)=0,04 mol
n H2=\(\dfrac{0,56}{22,4}\)=0,025 mol
=>HgO dư
=>m Hg=0,025.201=5,025g
nH2 = 0,56/22,4 = 0,025 (mol)
nHgO = 8,68/217 = 0,04 (mol)
PTHH: HgO + H2 -> (t°) Hg + H2O
LTL: 0,025 < 0,04 => H2 dư
nH2 (p/ư) = nHg = 0,025 (mol)
VH2 = (0,04 - 0,025) . 22,4 = 0,336 (l)
mHg = 0,025 . 201 = 5,025 (g)

\(n_{HgO}=\dfrac{43,4}{217}=0,2\left(mol\right)\)
PTHH: HgO + H2 --to--> Hg + H2O
0,2 0,2 0,2
\(\rightarrow\left\{{}\begin{matrix}m_{Hg}=201.0,2=40,2\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
nHgO = 43,4 : 217 = 0,2 (mol)
pthh : HgO + H2 -t> Hg + H2O
0,2 0,2 0,2
mHg = 0,2 . 201 = 40,2 (G)
VH2 = 0,2 . 22,4 = 4,48 (L)

Giải thích: Đáp án A
Nếu chẳng may trong phòng thí nghiệm nhiệt kế thủy ngân bị vỡ thì dùng Bột lưu huỳnh để thu hồi thủy ngân
2Hg + O2 → 2HgO
Phản ứng trên thuộc loại phản ứng hóa hợp
PTHH : 2Hg + O2 → 2HgO
- Đây là phản ứng hóa hợp