Cho 0,04 mol NaOH tác dụng vs 100ml dung dịch nhôm sunfat thì ko xuất hiện kết tủa. Tính nồng độ mol lớn nhất có thể của nhôm sunfat trong dung dịch đã cho
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 5 :
Phương pháp : Cho từ từ dung dịch $H_2SO_4$ đặc vào nước. Tuyệt đối không làm ngược lại do gây nguy hiểm.
Câu 6 :
a) $n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$b) n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al} = 0,1(mol)$
$m_{Al_2(SO_4)_3} = 0,1.342 = 34,2(gam)$
c)$n_{H_2SO_4} = \dfrac{3}{2}n_{Al} = 0,3(mol)$
$1600\ ml = 1,6\ lít$
$C_{M_{H_2SO_4}} = \dfrac{0,3}{1,6} = 0,1875M$
d) $n_{H_2} = n_{H_2SO_4} = 0,3(mol)$
$V_{H_2} = 0,3.22,4 = 6,72(lít)$
Câu 5: Bn có thể vào xem SGK lớp 9 nhé
Câu 6:
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
a. PTHH: 2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2\left(g\right)\)
b. Theo PT: \(n_{H_2SO_4}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\)
Đổi 1600ml = 1,6 lít
=> \(C_{M_{H_2SO_4}}=\dfrac{0,3}{1,6}=0,1875M\)
c. Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,3\left(mol\right)\)
=> \(V_{H_2}=0,3.22,4=6,72\left(lít\right)\)

Đáp án A
• 0,2 lít NaOH + 0,1 mol AlCl3 → ↓
Nung ↓ → 0,01 mol Al2O3
→ nAl(OH)3 = 0,02 mol.
• NaOH lớn nhất khi NaOH dư
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl (*)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (**)
Theo (*) nNaOH = 0,1 × 3 = 0,3 mol; nAl(OH)3 = 0,1 mol.
Theo (**) nAl(OH)3 phản ứng = 0,1 - 0,02 = 0,08 mol
→ nNaOH = 0,08 mol.
→ ∑nNaOH = 0,3 + 0,08 = 0,38 mol
→ CMNaOH = 0,38 : 0,2 = 1,9M

\(n_{CuSO_4}=\dfrac{20}{160}=0,125(mol)\\ a,CuSO_4+2NaOH\to Cu(OH)_2\downarrow+2NaCl\\ \Rightarrow n_{NaOH}=0,25(mol)\\ \Rightarrow C_{M_{NaOH}}=\dfrac{0,25}{0,2}=1,25M\\ b,n_{Cu(OH)_2}=0,125(mol)\\ \Rightarrow m_{Cu(OH)_2}=0,125.98=12,25(g)\\ c,Cu(OH)_2\xrightarrow{t^o}CuO+H_2O\\ \Rightarrow n_{CuO}=0,125(mol)\\ \Rightarrow m_{CuO}=0,125.80=10(g)\)

a) Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
b) \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH: Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
0,1---->0,3------->0,1
=> m = 0,1.342 = 34,2 (g)
c) \(C\%_{dd.H_2SO_4}=\dfrac{0,3.98}{120}.100\%=24,5\%\)

Gọi số mol Na2O và Al2O3 lần lượt là x, y
Nhận thấy khi thêm 0,1 mol HCl vào dung dịch X thì thấy xuất hiện kết tủa
→ Trong dung dịch X chứa NaAlO2 a mol và NaOH :0,1 mol
Bảo toàn nguyên tố → nNa2O = (nNaOH + nNaAlO2):2 = (0,1 + a): 2
nAl2O3 = nNaAlO2 : 2 = a:2
Ta có phương trình : [(0,1 + a): 2 ]×62 + (a:2)×102 = 19,5→ → a= 0,2 mol
CMNaOH = 0,2M, CMNaAlO2 = 0,4M
Đáp án C
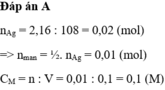
PTHH: 6NaOH + Al2(SO4)3 --> 3Na2SO4 + 2Al(OH)3
Số mol của Al2(SO4)3 là: 0,04 : 6 = 1/150 mol
Đổi : 100mo = 0,1 lít
CM = 1/150 : 0,1 = 1/15 M
KO KẾT TỦA!