khử hoàn toàn 16 gam fe2O3 bằng khí H2 dư thu được b (g) kim loại Fe . Đốt cháy hết lượng Fe này trong khí O2 thì thu đươc 23.2 g oxit sắt từ. Hãy viết các PTHH và tìm a và b
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe_2O_3\left(0,15\right)+3H_2\rightarrow2Fe\left(0,3\right)+3H_2O\)
\(3Fe\left(0,3\right)+2O_2\rightarrow Fe_3O_4\left(0,1\right)\)
\(n_{Fe_3O_4}=\frac{23,2}{232}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,15.160=24\left(g\right)\)
\(\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
Ta có: \(n_{Fe_3O_4}=\frac{23,2}{232}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 -to-> 2Fe + 3H2O (1)
3Fe + 2O2 -to-> Fe3O4 (2)
Theo các PTHH và đề bài, ta có:
\(n_{Fe\left(2\right)}=3.n_{Fe_3O_4\left(2\right)}=3.0,1=0,3\left(mol\right)\)
\(n_{Fe\left(1\right)}=n_{Fe\left(2\right)}=0,3\left(mol\right)\)
\(n_{Fe_2O_3\left(1\right)}=\frac{n_{Fe\left(1\right)}}{2}=\frac{0,3}{2}=0,15\left(mol\right)\)
Ta có: \(a=m_{Fe_2O_3\left(1\right)}=0,15.160=24\left(g\right)\)
\(b=m_{Fe\left(1\right)}=0,3.56=16,8\left(g\right)\)

nFe = 16,8 : 56 = 0,3 (mol)
pthh :3 Fe + 2O2 -t--> Fe3O4
0,3--------------> 0,1 (mol)
=> mFe3O4 =0,1 . 232 = 23,2(G)
nH2 = 44,8 : 22,4 = 2 (g)
pthh : Fe3O4 + H2 -t--> Fe + H2O
LTL : 0,1 / 1 < 2 /1
=> H2 du
nH2 (pu) = nFe3O4 = 0,1 (mol)
=> nH2 (d) = 2-0,1 = 1,9 (mol)
mH2 (d) = 1,9 . 2 = 3,8 (g)

PTHH:
Fe2O3 + 3H2 --> (nhiệt độ) 2Fe + 3H2O (1)
3Fe + 2O2 --> ( nhiệt độ) Fe3O4 (2)
nFe3O4=23.2 : 232 = 0.1 (mol)
PTHH (2) => nFe= 3nFe3O4 = 0.1 * 3 = 0.3 (mol)
=> b = mFe= 0.3*56 = 16.8 (g)
PTHH (1) => nFe= 2nFe3O4= 0.3 : 2 = 0.15 (mol)
=> a = mFe2O3 = 0.15 * 160 = 24 (g)

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
c, n\(n_{Fe}=2n_{Fe_2O_3}=0,3\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,6\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,6}{1,5}=0,4\left(M\right)\)

\(n_{O_2}=\dfrac{0.896}{22.4}=0.04\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(0.06......0.04.......0.02\)
\(m_{Fe}=0.06\cdot56=3.36\left(g\right)\)
\(m_{Fe_2O_3}=0.02\cdot232=4.64\left(g\right)\)

a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe +3 CO_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$RO + H_2 \xrightarrow{t^o} R + H_2O$
b)
Coi m = 160(gam)$
Suy ra: $n_{Fe_2O_3} = 1(mol)$
Theo PTHH :
$n_{RO} = n_{H_2} = n_{Fe} = 2n_{Fe_2O_3} = 2(mol)$
$M_{RO} = R + 16 = \dfrac{160}{2} = 80 \Rightarrow R = 64(Cu)$
Vậy oxit là CuO

Đáp án C
(FeO, Fe2O3, Fe3O4) + CO → Fe + CO2
CO2 + Ca(OH)2 dư → a gam ↓ CaCO3
Fe + HCl dư → V lít H2↑
• nFe = nH2 = V/22,4 mol; nCO = nCO2 = a/100 mol.
Theo bảo toàn khối lượng mhỗn hợp oxit = mFe + mCO2 - mCO
→ m = V/22,4 × 56 + a/100 × 44 - a/100 × 28 = 2,5V - 0,16a
1,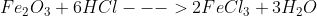
n: 0,1 0,2
vậy m = 0,2. 162,5 = 32,5 (g)