Từ 1 tấn quặng Lưu huỳnh có 2% tạp chất cho người ta có thể sản xuất bao nhiêu tấn dung dịch h2so4 98% với hiệu suất chung của quá trình sản suất là 80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_S=1000\cdot98\%=980\left(kg\right)\)
\(n_S=\dfrac{980}{32}=30.625\left(kmol\right)\)
\(S\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
\(30.625.........................30.625\)
\(m_{dd_{H_2SO_4}}=\dfrac{30.625\cdot98}{98\%}=3062.5\left(kg\right)\)
\(m_{dd_{H_2SO_4\left(tt\right)}}=3062.5\cdot98\%=3001.25\left(kg\right)\)

Đổi 1,2 tấn = 1200 kg
Ta có: \(n_{FeS_2}=\dfrac{1200}{120}=10\left(kmol\right)\)
Bảo toàn Lưu huỳnh: \(n_{H_2SO_4\left(lý.thuyết\right)}=2n_{FeS_2}=20\left(kmol\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(thực\right)}=\dfrac{20\cdot98}{50\%}\cdot80\%=3136\left(kg\right)=3,136\left(tấn\right)\)

ôi t làm nhầm....kq là
3,8 tấn ( cân bằng thêm 2 vào h2so4 là okok)
FeS2 ==> H2SO4
120g 98g
2,85( vì 5% tạp chất) 2,3275 (tấn)
vì H=80% ====> m H2SO4=1,3965( tấn). nhưng có C% H2SO4= 98%
VẬY mdd H2S04 là 1,425 tấn

Đáp án C.
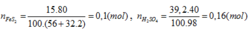
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

Khối lượng lưu huỳnh chứa trong 80 tấn quặng:
m S = 80x40/100 = 32 tấn
Điều chế H 2 SO 4 theo sơ đồ sau
S → SO 2 → SO 3 → H 2 SO 4
Ta thấy: Cứ 32g S thì sản xuất được 98g H 2 SO 4
⇒ m H 2 SO 4 = 32x98/32 = 98 tấn
Hiệu ứng phản ứng: H = 73,5/98 x 100 = 75%

quá trình sản xuất
FeS2-----> 2SO2------>2SO3--------->2H2SO4 (bảo toàn nguyên tố S )
120 196
4,5.80/100 ------------> x tấn H2SO4
====> x=2,88 tấn
H=90/100 ===> mH2SO4=90/100. 2,88=2,592 tấn
===> mđH2SO4= 2,592/98/100=2,65 tấn


