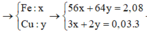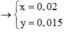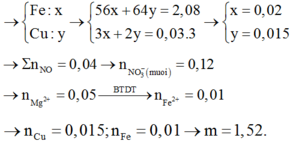Hoà tan hết 6,08g hỗn hợp gồm Cu, Fe bằng dd HNO3 thu được dd X và 1,792l NO (đkc). Thêm từ từ 2,88g bột vào dd Mg vào dd X đến khi xảy ra phản ứng hoàn toàn thư được 0,448l NO (đkc), dd Ý và m gầm chất rắn không tan. Giá trị của m là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Các phản ứng:
Do dung dịch thu được hòa tan tối đa Cu nên Fe cuối cùng lên Fe2+
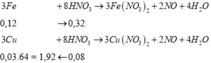
Cách bấm nhanh: mCu = [(0,4:4x3)-6,72:56x2]:2.64=1,92 gam

a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,9748}{24,79}=0,12\left(mol\right)\)
\(n_{Cu}=n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow m=m_{Zn}+m_{Cu}=0,1.65+0,12.64=14,18\left(g\right)\)
Có: \(n_{H_2SO_{4\left(đ\right)}}=2n_{SO_2}=0,24\left(mol\right)\Rightarrow x=m_{ddH_2SO_4\left(đ\right)}=\dfrac{0,24.98}{98\%}=24\left(g\right)\)

Đáp án C.
Chất rắn sau phản ứng gồm 2 kim loại → 2 kim loại đó là Cu và Fe , Al đã phản ứng hết → CuSO4 không dư → nCu = 0,105 mol => m= 6,72 gam → còn 1,12 gam là của Fe .
Phản ứng : Fe + 4HNO3 → Fe(NO3)3 + NO +2H2O
nFe = 0,02 mol → nHNO3= 0,08 mol .
n F e 3 + = 0,02 mol
chú ý phản ứng: Cu + 2Fe3+ → Cu2+ + 2Fe2+
⇒ 0,01 mol Cu + 0,02 mol Fe3+ → 0,01 mol Cu2+ và 0,02 mol Fe2+ )
Để HNO3 cần dùng là tối thiểu thì cần dùng 1 lượng hòa tan vừa đủ 0,105 – 0,01 = 0,095 mol Cu
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Từ đây tính được nHNO3= 0,095. 8 3 = 0,253 mol
→ tổng nHNO3 đã dùng là 0,253 + 0,08 = 0,333 mol
→ = 0,16667 lít = 166,67 ml

Đáp án C
n(Fe) = 0,02 mol; n(Cu) = 0,015 mol; n(Mg) = 0,05
Mg tạo NO = 0,015 → còn lại 0,035 mol phản ứng với kim loại
Sau phản ứng có: 0,01 mol Fe; 0,015 mol Cu → m = 1,52 gam

Có; \(n_{NO}+n_{N_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\dfrac{30n_{NO}+28n_{N_2}}{n_{NO}+n_{N_2}}=\dfrac{43}{3}.2=\dfrac{86}{3}\)
=> nNO = 0,1 (mol); nN2 = 0,2(mol)
Al0 -3e --> Al+3
a-->3a--->a
Mg0 -2e --> Mg+2
b---->2b---->b
Fe0 -3e --> Fe+3
c--->3c---->c
4H+ + NO3- +3e --> NO + 2H2O
0,4<----------0,3<----0,1
12H+ + 2NO3- +10e--> N2 + 6H2O
2,4<---------------2<-----0,2
10H+ + 2NO3- +8e--> NH4NO3 + 3H2O
0,5<-------------0,4<-----0,05
=> nHNO3 = nH+ = 0,4 + 2,4 + 0,5 = 3,3 (mol)
=> \(V_{dd}=\dfrac{3,3}{1}=3,3\left(l\right)\)
Bảo toàn H: \(n_{H\left(HNO_3\right)}=n_{H\left(NH_4NO_3\right)}+n_{H\left(H_2O\right)}\)
=> 3,3 = 4.0,05 + 2.nH2O
=> nH2O = 1,55(mol)
Theo ĐLBTKL:
\(m_{hh\left(bd\right)}+m_{HNO_3}=m_{muoi}+m_{NH_4NO_3}+m_{NO}+m_{N_2}+m_{H_2O}\)
=> hh muỗi khan = \(m_{muoi}+m_{NH_4NO_3}=11,9+3,3.63-30.0,1-28.0,2-18.1,55=183,3\left(g\right)\)
=> A
Đặt \(n_{NO}=a(mol);n_{N_2}=b(mol)\)
\(\Rightarrow \begin{cases} a+b=\dfrac{6,72}{22,4}=0,3(mol)\\ \dfrac{30a+28b}{a+b}=2.\dfrac{43}{3}=\dfrac{86}{3} \end{cases}\Rightarrow \begin{cases} a=0,1(mol)\\ b=0,2(mol) \end{cases}\\ \Rightarrow \Sigma n_{HNO_3}=4n_{NO}+12n_{N_2}+10n_{NH_4NO_3}=3,3(mol)\\ \Rightarrow V_{dd_{HNO_3}}=\dfrac{3,3}{1}=3,3(l)\\ n_{NO_3-(muối)}=3n_{NO}+10n_{N_2}+8n_{NH_4NO_3}=2,7(mol)\\ \Rightarrow m_{muối}=m_{NO_3-(muối)}+m_{KL}+m_{NH_4NO_3}=2,7.62+11,9+0,05.80=183,3(g) \)
Chọn A