KHỬ HOÀN TOÀN 4,06 GAM MỘT OXIT KIM LOẠI m BẰNG 3,136 LÍT CO Ở nhiệt độ cao thành kim loại khí X. tỉ khối của X so vs H2 là 18. xác định công thức của oxit kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức oxit ban đầu là MxOy.
Có phản ứng khử hoàn toàn oxit MxOy thành kim loại:
![]()
Dẫn khí CO2 sinh ra hấp thụ vào dung dịch Ca(OH)2 dư:
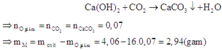
Cần lưu ý: Hóa trị của kim loại M trong oxit ban đầu và hóa trị của M trong sản phẩm của phản ứng giữa M với axit HCl có thể khác nhau.
Do đó ta gọi n là hóa trị của M thể hiện khi phản ứng với axit HCl.
![]()
Áp dụng định luật bào toàn mol electron, ta có:
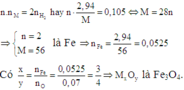
Đáp án D.

Đáp án C
nCO2 = nCaCO3 = 0,07 mol
O + CO → CO2
0,07 ← 0,07
mKL = moxit – mO
= 4,06 – 0,07.16 = 2,94 (g)
Gọi hóa trị của KL khi tác dụng với HCl là n
M → 0,5n H2
0,105/n← 0,0525 (mol)
![]()
![]()
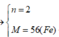
![]()
![]()

`a)`
Oxit: `Fe_xO_y`
`Fe_xO_y+yCO` $\xrightarrow{t^o}$ `xFe+yCO_2`
`CO_2+Ca(OH)_2->CaCO_3+H_2O`
Theo PT: `n_{CO_2}=n_{CaCO_3}=7/{100}=0,07(mol)`
`->n_{Fe_xO_y}={n_{CO_2}}/y={0,07}/y(mol)`
`->M_{Fe_xO_y}={4,06}/{{0,07}/y}=58y`
`->56x+16y=58y`
`->x/y={42}/{56}=3/4`
`->` Oxit: `Fe_3O_4`
`b)`
`n_{Fe_3O_4}={4,06}/{232}=0,0175(mol)`
`2Fe_3O_4+10H_2SO_4->3Fe_2(SO_4)_3+SO_2+10H_2O`
Đề thiếu.

Đáp án D
Ta có: n C O 2 = 0 , 24 → n O ( o x i t ) = 0 , 24 m o l
Nếu đáp án là FeO hoặc CuO thì n M = 0 , 24 → m = 37 , 333
Vậy M là Fe → m M = 0 , 16 → n M : n O = 2 : 3
Vậy oxit cần tìm là Fe2O3

Đáp án D
Ta có:
![]()
Nếu đáp án là FeO hoặc CuO thì
![]()
Vậy M là Fe
![]()
Vậy oxit cần tìm là Fe2O3

PTHH: AxOy + yCO --to--> xA + yCO2
Có: nCO(dư) + nCO2 = nCO(bd) = \(\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Mà \(\dfrac{28.n_{CO\left(dư\right)}+44.n_{CO_2}}{n_{CO}+n_{CO_2}}=20,4.2=40,8\)
=> nCO2 = 0,048 (mol)
\(n_{A_xO_y}=\dfrac{2,784}{x.M_A+16y}\left(mol\right)\)
AxOy + yCO --to--> xA + yCO2
=> \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{2,784y}{x.M_A+16y}=0,048\left(mol\right)\left(1\right)\\n_A=\dfrac{2,784x}{x.M_A+16y}\left(mol\right)\end{matrix}\right.\)
(1) => \(M_A=\dfrac{42y}{x}=>\dfrac{y}{x}=\dfrac{M_A}{42}\) (2)
PTHH: 2A + 2nHCl --> 2ACln + nH2
=> \(n_{H_2}=\dfrac{1,392xn}{x.M_A+16y}=0,036\left(mol\right)\)
=> \(1,392n=0,036.M_A+\dfrac{0,576y}{x}\) (3)
(2)(3) => MA = 28n
Xét n = 1 => L
Xét n = 2 => MA = 56 (Fe) => \(\dfrac{x}{y}=\dfrac{3}{4}\) => CTHH: Fe3O4
Xin cảm ơn mọi người đã đọc câu hỏi này nhưng em đã nghĩ ra đáp án cho bài tập này rồi ạ

\(n_{CO} = n_{CO_2} = n_{BaCO_3} = \dfrac{94,56}{197} = 0,48(mol)\)
Bảo toàn khối lượng :
\(m_{kim\ loại} = m_{oxit} + m_{CO} - m_{CO_2} = 27,84 + 0,48.28 -0,48.44 = 20,16(gam)\)
\(n_{H_2} = \dfrac{8,064}{22,4} = 0,36(mol)\)
2R + 2nHCl → 2RCln + nH2
\(\dfrac{0,72}{n}\).............................0,36...........(mol)
Suy ra: \(\dfrac{0,72}{n}\).R = 20,16 ⇒ R = 28n. Với n = 2 thì R = 56(Fe)
CO + Ooxit → CO2
0,48.....0,48...............(mol)
Ta có: \(\dfrac{n_{Fe}}{n_O} = \dfrac{0,36}{0,48} = \dfrac{3}{4}\). Vậy oxit sắt là Fe3O4

ta có dX/H2= 18====> MX=36 ( Vậy X k chỉ có C02 mà còn cả C0 dư) . nc0=0,14(mol)
áp dụng đường chéo====> 44 C02 8
36
28 C0 8
=====>>>> nC02=n C0 dư=x( mol)