Thực hiên phản ứng nhiêt nhôm vs 25g hh gồm Al va fe2o3 thu dk hh B.Cho B td vs dd NaOH dư dk 14,8g hh C ,k thấy khong khí thoát ra.tính % m fe2o3 trong hh A là???? Giup mk với
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Y tác dụng NaOH cho khí hydrogen nên Y có Al dư.
\(2Al+Fe_2O_3-t^0>Al_2O_3+2Fe\\ Y:Al_{dư}\left(a\left(mol\right)\right),Fe\left(2b\left(mol\right)\right),Al_2O_3\left(b\left(mol\right)\right)\\ n_{H_2}=\dfrac{3}{2}a+2b=0,4\\ n_{Al\left(dư\right)}=\dfrac{2}{3}n_{H_2}=0,2mol=a\\ b=0,05mol\\ BTKL:m=27a+56\cdot2b+102b=16,1g\)

Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
PTHH:
\(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
b--------------->0,5b
\(2Mg+O_2\xrightarrow[]{t^o}2MgO\)
a---------------->a
\(\rightarrow\left\{{}\begin{matrix}24a+27b=5,1\\40a+102b=9,1\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\left(TM\right)\)\
PTHH:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
0,1----------------------------->0,1
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)+3H_2\uparrow\)
0,1----------------------------------->0,15
=> V = (0,1 + 0,15).22,4 = 5,6 (l)
Ở trên Al2O3 là 0,5b (mol) mà sao xuống dưới Al2O3 b(mol) em?

Vì các phản ứng hoàn toàn mà khi cho Y + NaOH ----> H2 chứng tỏ Al dư, Fe2O3 chuyển hết thành Fe. Vậy trong Y có chứa Al: 0,03 mol ( nH2 = 3/2nAl); nFe = 0,06 mol (mFe = m rắn = 3,36 g)
Từ pư: 2Al + Fe2O3 ---> Al2O3 + 2Fe => nFe2O3 = nAl2O3, mà nFe2O3 = nFe/2 => nAl2O3 = 0,03 mol
m phần 1 = 7,23 g => m phần 2 = 21,69 g. Hay p2 = 3 p1
=> Trong phần 2 có: Al: 0,09 mol; Fe: 0,18 mol; Al2O3: 0,09 mol
Bảo toàn e (giả sử chỉ tạo Fe2+, vì ta chưa biết sản phẩm có Fe3+ hay không): 3nNO < 3nAl + 2nFe => có NH4+
Gọi số mol Fe2+: x, Fe3+: y, NH4+: z
=> Bảo toàn electron: 0,09.3 + 2x + 3y = 0,17.3 + 8z
x + y = 0,18 (bảo toàn Fe)
1,52 = 0,09.3.2 ( nH+ phản ứng với Al2O3) + 0,17.4 + 10z
=> x = 0,06; y = 0,12; z = 0,03
Bảo toàn N: nNO3- = nHNO3 - nNO - nNH4+ = 1,32 mol
=> m = 21,69 + NO3- = 103,53 g

\(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
PTHH:
\(CH_3COOC_2H_5+NaOH\rightarrow CH_3COONa+C_2H_5OH\)
0,1<-----------------0,1-------------------------------->0,1
\(C_2H_5OH+Na\rightarrow C_2H_5ONa+\dfrac{1}{2}H_2\)
0,15<--------------------------------0,075
\(\rightarrow n_{C_2H_5OH\left(bđ\right)}=0,15-0,1=0,05\left(mol\right)\\ \rightarrow m=0,05.46+88.0,1=11,1\left(g\right)\)

a, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Cu}=24-m_{Fe}=12,8\left(g\right)\) \(\Rightarrow n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{CuO}=n_{Cu}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
⇒ m = mCuO + mFe2O3 = 0,2.80 + 0,1.160 = 32 (g)
b, \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,2.80}{32}.100\%=50\%\\\%m_{Fe_2O_3}=50\%\end{matrix}\right.\)
c, Theo PT: \(n_{H_2}=n_{CuO}+3n_{Fe_2O_3}=0,5\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,5.22,4=11,2\left(l\right)\)

\(n_{Fe_2O_3}=n_{FeO}=n_{Fe_3O_4}=a\\ n_{NO_2}:n_{NO}=\dfrac{46-34}{34-30}=3\\ n_{NO_2}+n_{NO}=\dfrac{4,48}{22,4}=0,2\\ n_{NO_2}=0,15;n_{NO}=0,05\\ BTe:a+a=0,15+0,15\\ a=0,15\\ m_A=a\left(160+232+72\right)=69,6g\\ BT\left[N\right]:V_{HNO_3}=\dfrac{6a\cdot3-0,2}{2}=1,25L\)
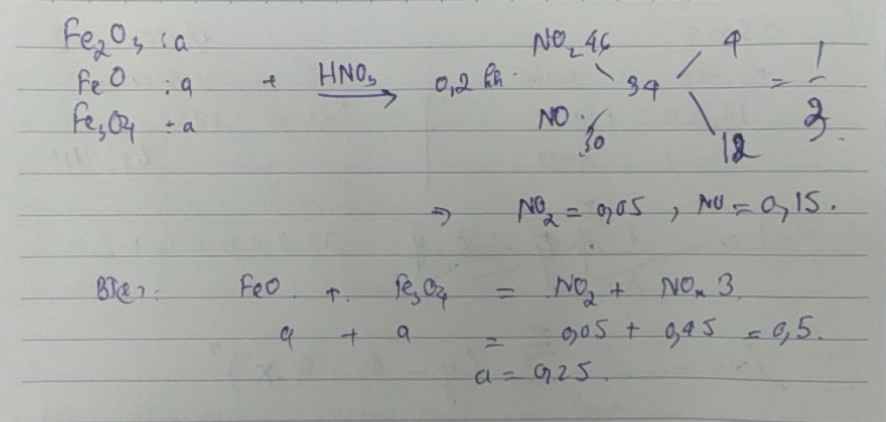
2Al + Fe2O3 -> Al2O3 + 2Fe
0.1 0.1
Al2O3 + 2NaOH -> H2O + 2NaAlO2
0.1 0.2
n(NaAlO2) = 14.8/82=0.2 mol
m(Fe2O3)= 0.1*160=16(g) ->m Al =25 - 16 = 9(g)
%m(Al)=(9*100)/25=36 %
giup mk voi hay cho biet giới han đo cua thươc cuon