hòa tan hoàn toàn 20 gam hỗn hợp Y gồm Zn và Cu vào một lượng vừa đủ dung dịch HCl 0.5M thu được 4.48 lít H2 (đktc) và m gam chất rắn ko tan.tính % khối lượng từng chất trong Y và thể thích axit đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



dạ em cảm ơn anh/thầy nhưng mà cái tổng HCl ra m bấm máy sai rồi ạ vs cảm ơn anh/thầy giúp em giải bài nha

\(n_{CuO}=n_{Cu}=\dfrac{4}{80}=0,05mol\\ n_{H_2}=0,4mol\\ n_{Al}=a;n_{Zn}=b\\ 27a+65b=15,1-0,05\cdot64\\ BTe^-:3a+2b=2\cdot0,4\\ a=0,2;b=0,1\\ m_{ddHCl}=\dfrac{\left(0,6+0,2\right)\cdot36,5}{0,2}=146g\)

a) \(n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,05<-----------0,05---->0,075
=> \(\%Al=\dfrac{0,05.27}{14,15}.100\%=9,54\%\)
=> \(\%Cu=\dfrac{14,15-0,05.27}{14,15}.100\%=90,46\%\)
b) \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
c) \(n_{Cu}=\dfrac{14,15-0,05.27}{64}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
2Cu + O2 --to--> 2CuO
0,2-->0,1
=> \(V_{O_2}=\left(0,1+0,0375\right).22,4=3,08\left(l\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ m_{AlCl_3}=6,675\left(mol\right)\\ n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\\ \Rightarrow n_{Al}=n_{AlCl_3}=0,05\left(mol\right)\\ \Rightarrow m_A=0,05.27=1,35\left(g\right);m_{Cu}=14,15-1,35=12,8\left(g\right)\\ \%m_{Cu}=\dfrac{12,8}{14,15}.100\approx90,459\%\\ \Rightarrow\%m_{Al}\approx9,541\%\\ b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ 2Cu+O_2\rightarrow\left(t^o\right)2CuO\\ n_{O_2}=\dfrac{3}{4}.n_{Al}+\dfrac{1}{2}.n_{Cu}=\dfrac{3}{4}.0,05+\dfrac{1}{2}.0,2=0,0875\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,0875.22,4=1,96\left(l\right)\)

\(n_{H_2}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\\ Đặt:n_{Al}=a\left(mol\right);n_{Fe}=b\left(mol\right)\left(a,b>0\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=27,8\\1,5a+b=0,7\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,4\end{matrix}\right.\\ a,\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%=19,424\%\\\Rightarrow\%m_{Fe}=80,576\%\\ b,n_{HCl}=3a+2b=1,4\left(mol\right)\\ m_{ddHCl}=\dfrac{1,4.36,5.100}{20}=255,5\left(g\right) \Rightarrow4\approx\approx\approx\Rightarrow FeHCm=\)

a) Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 8,56 (1)
\(n_{H_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--->2a-------->a----->a
Fe + 2HCl --> FeCl2 + H2
b----->2b------->b------>b
=> a + b = 0,14 (2)
(1)(2) => a = 0,08; b = 0,06
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,08.65}{8,56}.100\%=60,748\%\\\%m_{Fe}=\dfrac{0,06.56}{8,56}.100\%=39,252\%\end{matrix}\right.\)
b)
nKOH = 0,2.0,1 = 0,02 (mol)
PTHH: KOH + HCl --> KCl + H2O
0,02-->0,02
=> nHCl = 0,02 + 2a + 2b = 0,3 (mol)
=> \(C_{M\left(HCl\right)}=xM=\dfrac{0,3}{0,15}=2M\)
c) m = 0,08.136 + 0,06.127 = 18,5(g)



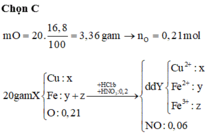
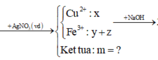
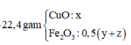
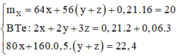
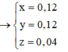
Cu ko td vs HCl.
Zn+2HCl=ZnCl2+H2
nH2=o.2 mol =nZn
mZn=0.2×65=13g
mCu=20-13=7g.
nHCl=2nH2=0.4mol.
VHCl=n\CM =0.8l