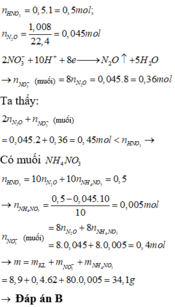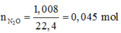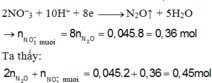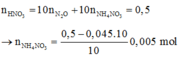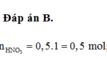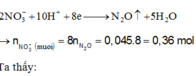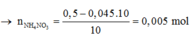Hòa tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 1,008 lít khí N2O (đktc) duy nhất và dung dịch X chứa m gam muối. Giá trị của m là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
Số mol N2O = 1,008/22,4 = 0,045 mol;
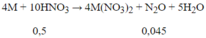
Số mol HNO3 phản ứng = 0,045.10 = 0,45 mol < 0,5 suy ra có tạo sản phẩm khử khác là NH4NO3
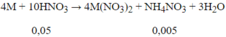
Vậy m = 8,9 + 62.( 8.0,045+8.0,005)+ 80.0.005=34,1g

Gọi n Mg = a; n Zn = b ⇒ 24a + 27b = 8,9g (1)
nHNO3 ban đầu = 0,5
nN2O = 0,045
Gọi số mol muối NH4NO3 là x mol
Bảo toàn e ta có: 2nMg + 2nZn = 8nN2O + 8nNH4NO3
⇒ 2a + 2b – 8x = 0,36 (2)
Bảo toàn nguyên tố N ta có:
n HNO3 = n NO3- trong muối KL + 2n NH4NO3 + 2n N2O
⇒10n N2O + 10n NH4NO3 = 0,5 mol ( n NO3- trong muối KL = n e = 8n NH4NO3 + 8n N2O)
⇒ n NH4NO3 = 0,005 (mol)
⇒ n NO3- trong muối KL = 0,4 mol
mmuối = mNO3-/muối KL + mKL + mNH4NO3 = 0,4.62 + 8,9 + 0,005.80 = 34,1
Đáp án B.

Chọn B
Ta có nN2O = 0,045 mol; nH+ = nHNO3 = 0,5 mol
10H+ + 2NO3- + 8e → N2O + 5H2O
0,45 ← 0,09 ← 0,36 ← 0,045
Do nH+ tạo N2O < nH+bđ mà HNO3 lại phản ứng vừa đủ nên có thêm phản ứng
10H+ + NO3- + 8e → NH4+ + 3H2O
(0,5 – 0,45) → 0,005→ 0,04 → 0,005
⇒ mmuối = mkim loại + 62.ne + mNH4NO3 = 8,9 + 62.(0,36 + 0,04) + 80.0,005 = 34,1g

Đáp án B
![]()
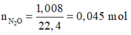
2NO−3 + 10H+ + 8e → N2O↑ + 5H2O
→ n N O 3 - ( m u ố i )
![]()
Ta thấy:
2 n N 2 O + n N O 3 - ( m u ố i ) = 0,045.2 + 0,36 = 0,45 mol < n H N O 3 =>Có muối NH4NO3.
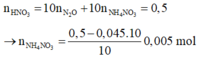
n N O 3 - ( m u ố i ) =
![]()
= 0,4 mol
![]()
![]()