Đốt cháy hoàn toàn m g chất khí A thu được 6,6 g khí CO2và 2,7 g H2O. Ở cùng đk to và p 3,7 g khí A có thể tích bằng thể tích của 1,6g O2. biết trong A có 2 nguyên tử oxi. Tìm m và công tức của A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CO_2}=\dfrac{4.4}{44}=0.1\left(mol\right)\)
\(n_{H_2O}=\dfrac{1.8}{18}=0.1\left(mol\right)\)
\(m_O=3-0.1\cdot12-0.1\cdot2=1.6\left(g\right)\)
\(n_O=\dfrac{1.6}{16}=0.1\left(mol\right)\)
\(CT:C_xH_yO_z\)
\(x:y:z=0.1:0.2:0.1=1:2:1\)
\(CTnguyên:\left(CH_2O\right)_n\)
\(M_A=\dfrac{3}{\dfrac{1.6}{16}}=30\left(đvc\right)\)
\(\Leftrightarrow30n=30\)
\(\Leftrightarrow n=1\)
\(CTPT:CH_2OhayHCHO\)

1. C 2 H 4 O .
2. Số mol A trong 1,10 g A = số mol O 2 trong 0,40 g O 2
n
O
2

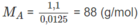
( C 2 H 4 O ) n = 88 ⇒ 44n = 88 ⇒ n = 2
CTPT là C 4 H 8 O 2 .

MA= 1,0625*32 = 34 g/mol (1)
Vì đốt khí A thu dc SO2 va2H2O -> A chứa S, H
nS= 2,24/22,4=0,1 mol
nH= 2nH2O= 2*(1,8/18)=0,2 mol
nH : nS = 0,2 :0,1 =2:1 (2)
(1)(2)=> A là H2S
2H2S + 3O2 -> 2SO2 + 2H2O
0,1 0,15
nH2S= 3,4/34=0,1 mol
VO2= 0,15*22,4=3,36 l

a) Áp dụng ĐLBTNT:
+) Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
+) Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{2,7}{18}=0,3\left(mol\right)\)
+) Bảo toàn: \(n_O=\dfrac{3,7-0,3-0,15.12}{16}=0,1\left(mol\right)\)
CTPT: CxHyOz
=> x : y : z = 0,15 : 0,3 : 0,1 = 3 : 6 : 2
=> CTPT: C3H6O2
b) A là: CH3-CH2-COOH
B là: CH3COOCH3

nCO2 = \(\dfrac{6,72}{22,4}\)= 0,3 mol , nH2O = \(\dfrac{5,4}{18}\)= 0,3 mol
=> mC = 0,3.12 = 3,6 gam , mH = 2nH2O . 1 = 0,6gam
mC + mH = 4,2g < mA => Trong A ngoài C và H còn có Oxi
mO = 5,8 - 4,2 = 1,6 gam <=> nO = 1,6/16 = 0,1 mol
Gọi CTĐGN của A là CxHyOz
Ta có x:y:z = nC:nH:nO = 3:6:1 => CTPT của A là (C3H6O)n
2,32 g A có thể tích = 1/3 thể tích 1,92 gam O2 ở cùng điều kiện
=> 2,32 g A có số mol = 1/3 số mol của 1,92 gam O2 = \(\dfrac{1,92}{32.3}\)= 0,02mol
<=> MA = \(\dfrac{2,32}{0,02}\)= 116(g/mol)
=> n = 2 và CTPT của A là C6H12O2
b) B tác dụng được với KOH, CaCO3 => B là axit cacboxylic
CH3-(CH2)4-COOH

Số mol 2 chất trong 2,58 g M: 
Số mol 2 chất trong 6,45 g M: 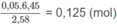
Khi đốt hỗn hợp M, thu được C O 2 và H 2 O ; vậy các chất trong hỗn hợp phải chứa C và H, có thể có O. Hai chất lại kế tiếp nhau trong một dãy đồng đẳng (nghĩa là hom nhau 1 nhóm CH2) nên công thức phân tử hai chất đó là C x H y O z và C x + 1 H y + 2 O z (x, y nguyên và > 0; z nguyên và > 0).
Giả sử trong 6,45 g M có a moi C x H y O z và b mol C x + 1 H y + 2 O z :
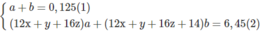
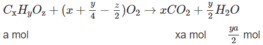
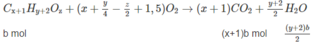
Số mol C O 2 :
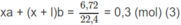
Số mol H 2 O :
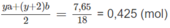
⇒ ya + (y + 2)b = 0,85 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,300
b = 0,300-0,125x
0 < b < 0,125 ⇒ 0 < 0,300 - 0,125x < 0,125
1,40 < x < 2,40
⇒ x = 2; b = 0,300 - 0,125.2 = 0,05.
⇒ a = 0,125 - 0,05 = 0,075.
Thay giá trị của a và b vào (4) ta có :
0,0750y + 0,0500(y + 2) = 0,85
⇒ y = 6.
Thay giá trị của a, b, x, y vào (2) ta tìm được z = 1.
Thành phần hỗn hợp M :
Khối lượng
C
2
H
6
O
chiếm 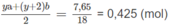
Khối lượng
C
3
H
g
O
chiếm 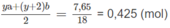

Số mol 2 chất trong 6,55 g M là: 
Số mol 2 chất trong 2,62 g M là: 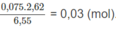
Giả sử trong 2,62 g M có a mol C x H y và b mol C x + 1 H y + 2
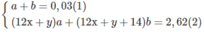
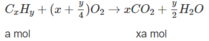
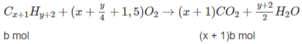
xa + (x + 1)b = 0,2 (3)
Từ (3), ta có x(a + b) + b = 0,2
b = 0,2 - 0,03x
Vì 0 < b < 0,03 nên 0 < 0,2 - 0,03x < 0,03.
⇒ 5,67 < x < 6,67 ⇒ x = 6 .
b = 0,2 - 0,03.6 = 0,02; a = 0,03 - 0,02 = 0,01
Thay giá trị của a và b vào (2), tìm được y = 6.
Khối lương
C
6
H
6
chiếm 
Khối lương C 7 H 8 chiếm 100 - 29,8% = 70,2%.
Gọi CT của A là CxHyO2.
CxHyO2 + (x+y/4 - 1)O2 ---> xCO2 + y/2H2O
Trong 3,7 gam khí A, có số mol = 1,6/32 = 0,05 mol. Do đó phân tử khối của A = 3,7/0,05 = 74. Do đó: 12x + y = 74 - 32 = 42.
Mặt khác số mol của CO2 = 6,6/44 = 0,15 mol; số mol H2O = 2,7/18 = 0,15 mol = số mol CO2. Dựa vào pt phản ứng ta có: y = 2x.
Giải hệ 2 pt trên thu được x = 3; y = 6. CT của A: C3H6O2.
Số mol A = 1/3 số mol CO2 = 0,05 mol. Suy ra m = 74.0,05 = 3,7 g.