Nhỏ từ từ tới dư dung dịch Ba(OH)2 0,5M vào 200 ml dung dịch Al2(SO4)3 aM. Đồ thị biểu diễn lượng kết tủa thu được theo thể tích dung dịch Ba(OH)2 như sau: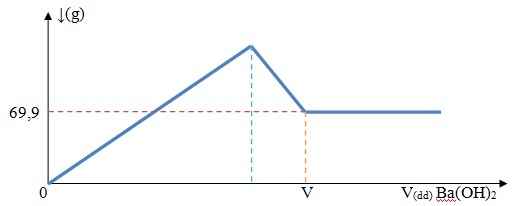
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Định hướng tư duy giải
Tại vị trí kết tủa đạt cực đại
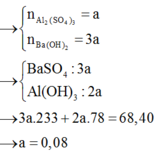
Tại vị trí Al(OH)3 tan hết
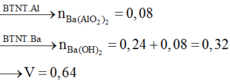

Chọn đáp án B
Định hướng tư duy giải
Tại vị khí lượng kết tủa là 62,91 gam:
n B a S O 4 = 0 , 27 → n A l 3 + = 0 , 27 . 2 3 = 0 , 18

Tại vị trí lượng kết tủa cực đại
n B a ( O H ) 2 = n S O 4 2 - = 0 , 27 → V 1 = 0 , 54 → V 2 : V 1 = 4 : 3

Chọn đáp án B
Tại V thì kết tủa chỉ chứa BaSO4 với
n B a S O 4 = 69 , 9 233 = 0 , 3 m o l → n A l 2 ( S O 4 ) 3 = n B a S O 4 3 = 0 , 1 m o l ⇒ n B a ( O H ) 2 = 4 n A l 3 + 2 = 8 n A l 2 ( S O 4 ) 3 2 = 0 , 4 m o l ⇒ V B a ( O H ) 2 = 2 l í t

Đáp án A.
Theo đồ thị n S O 4 2 - = 0,03 mol → n A l 2 ( S O 4 ) 3 = 0,01 mol
Hỗn hợp bazơ gồm: Ba2+ (0,02 mol); Na+ (0,03 mol) và OH- (0,7 mol) tác dụng với dung dịch A gồm: Al3+ (0,02 mol) và SO42- (0,03 mol) ta có PTHH:
Ba2+ + SO42- → BaSO4
0,02---------------0,02 mol
Al3+ + 3OH- → Al(OH)3
0,02---0,06------0,02 mol
Al(OH)3 + OH- → AlO2- + 2H2O
0,01---------0,01
Khối lượng kết tủa = m B a S O 4 + m A l ( O H ) 3 = 5,44 gam

Đáp án B
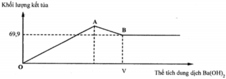
Tại thời điểm A trên đồ thị, kết tủa cực đại gồm BaSO4 và Al(OH)3.
Sau đó, thêm tiếp Ba(OH)2 thì không có gốc sunfat hay ion nhôm để kết tủa nữa, diễn ra quá trình hòa tan Al(OH)3, đến điểm B thì hòa tan hết, kết tủa không thay đổi → Phản ứng tổng từ O → B là:
Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4↓ + Ba(AlO2)2 + H2O.
Đơn giản là dựa vào tỉ lệ phương trình trên đề giải, hoặc hiểu quá trình trong đầu, đặt câu hỏi với các giả thiết: 69,9 gam là 0,3mol BaSO4; tại điểm này, dung dịch chỉ chứa BaSO4↓ và Ba(AlO2)2 nên bảo toàn SO4 có 0,1mol Al2(SO4)3 → có 0,1mol Ba(AlO2)2 theo bảo toàn Al → Σsố mol Ba(OH)2 dùng là 0,4.
Vậy, giá trị của V là: 0,4 : 0,1 = 4M.
3Ba(OH)2 + Al2(SO4)3 → 2Al(OH)3 + 3BaSO4↓ (1)
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O (2)
Kết tủa có thể là BaSO4 và Al(OH)3
Tại điểm V, khi thêm Ba(OH)2 thì lượng kết tủa vẫn không đổi
=> Kết tủa chỉ còn BaSO4
Ta có : nBaSO4=\(\dfrac{69,9}{233}\)=0,3(mol)
Bảo toàn nguyên tố S : => nAl2(SO4)3.3=nBaSO4.1
=> 0,2.a.3 = 0,3
=> a= 0,5M
=> nAl2(SO4)3=0,5.0,2=0,1(mol)
Từ PT (1) => nAl(OH)3=2nAl2(SO4)3=0,2(mol)
Tại V, từ PT (1), (2) ta có : nBa(OH)2=3nAl2(SO4)3+\(\dfrac{1}{2}\)nAl(OH)3=0,4(mol)
=> VBa(OH)2=\(\dfrac{0,4}{0,5}\)=0,8(l)