Tính pH của các dung dịch sau :
a. Dung dich H2SO4 0,03M
b. Hoà tan 12 gam NaOH vào 500ml nước.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Đặt nNaOH = a , nKOH =b.
Thu được 2 muối là : NaCl (a mol) và KCl (b mol)
Có hệ
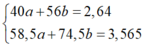
nOH- = a + b = 0,05 ⇒ [OH-] = 0,05 : 0,5 = 0,1 ⇒ pH = 13.
Đáp án D.

\(a,n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\\ C_{M\left(HCl\right)}=\dfrac{0,2}{0,4}=0,5M\\ b,n_{H_2SO_4}=\dfrac{73,5}{98}=0,75\left(mol\right)\\ C_{M\left(H_2SO_4\right)}=\dfrac{0,75}{0,5}=1,5M\\ n_{NaOH}=\dfrac{16}{40}=0,4\left(mol\right)\\ C_{M\left(NaOH\right)}=\dfrac{0,4}{0,25}=1,6M\\ n_{Ba\left(OH\right)_2}=\dfrac{34,2}{171}=0,2\left(mol\right)\\ C_{M\left(Ba\left(OH\right)_2\right)}=\dfrac{0,2}{0,8}=0,25M\)

a) \(m_{HCl}=200\cdot7,3\%=14,6\left(g\right)\)
b) \(n_{NaOH}=0,5\cdot1=0,5\left(mol\right)\) \(\Rightarrow m_{NaOH}=0,5\cdot40=20\left(g\right)\)
c) \(n_{CuSO_4}=0,2\cdot1,5=0,3\left(mol\right)\) \(\Rightarrow m_{CuSO_4}=0,3\cdot160=48\left(g\right)\)
d) Bạn xem lại đề !
a) mHCl=200⋅7,3%=14,6(g)mHCl=200⋅7,3%=14,6(g)
b) nNaOH=0,5⋅1=0,5(mol)nNaOH=0,5⋅1=0,5(mol) ⇒mNaOH=0,5⋅40=20(g)⇒mNaOH=0,5⋅40=20(g)
c) nCuSO4=0,2⋅1,5=0,3(mol)nCuSO4=0,2⋅1,5=0,3(mol) ⇒mCuSO4=0,3⋅160=48(g)⇒mCuSO4=0,3⋅160=48(g)
d) Bạn xem lại đề !

nNaOH = 0,5a mol, nH2SO4 = 0,3 mol, nAl2O3 = 0,0052 mol
TH1: Dung dịch A chứa H2SO4 dư
2NaOH + H2SO4 ➝ Na2SO4 + 2H2O
0,5a 0,25a
➝ nH2SO4 dư = 0,3 - 0,25a (mol)
2Al + 3H2SO4 ➝ Al2(SO4)3 + 3H2
2(0,3-0,25a)/3 (0,3 - 0,25a)
➝ nAl = \(\dfrac{2\left(0,3-0,25a\right)}{3}=0,0052\) ➝ a = 1,1688
TH2: NaOH dư
2NaOH + H2SO4 ➝ Na2SO4 + 2H2O
0,6 0,3
➝ nNaOH dư = 0,5a - 0,6 mol
Al2O3 + 2NaOH ➝ 2NaAlO2 + H2O
(0,5a - 0,6)/2 (0,5a - 0,6)
➝ \(\dfrac{0,5a-0,6}{2}=0,0052\) ➝ a = 1,2208

Bài tập vận dụng
VD1: Hoà tan hoàn toàn 7,45 gam KCI vào 200ml H2O thu đưoc dung dịch A. Tính nồng độ %, nồng độ mol/l
của dung dịch A.
VD2: Hoà tan hoàn toàn 0,2 mol NaOH vào 500ml H20 thu được dung dịch B. Tính nồng độ %, nồng độ mol/l
của dung dịch B.
VD3: Hoà tan hoàn toàn 2,8 gam KOH và 5,85 gam NaCl vào 600 ml H2O thu được dung dịch C. Tinh nồng độ
%, nồng độ mol/l của dung dịch C.
VD4: Hoà tan hoàn toàn 4,6 gam Na vào 100 gam H20 thu được dung dịch D. Tính nồng độ %, nồng độ mol/I
của dung dịch D.
VD5: Hoà tan hoàn toàn 2,74 gam Ba vào 200 gam H2O thu được dung dịch E. Tính nồng độ %, nồng độ mol/l
của dung dịch E.
VD6: Hoà tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400ml H2O thu đưoc dung dịch F. Tính nồng đo %,
nồng đo mol/l của dung dịch F.
VD1:
\(n_{KCl}=\dfrac{7,45}{74,5}=0,1\left(mol\right)\\ V_{ddKCl}=V_{H_2O}=200\left(ml\right)=0,2\left(l\right)\\ C_{MddKCl}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

\(n_{SO_3}=\dfrac{20}{80}=0,25\left(mol\right)\\ PTHH:SO_3+H_2O\rightarrow H_2SO_4\\ Mol:0,25\rightarrow0,25\rightarrow0,25\\ C_{MH_2SO_4}=\dfrac{0,25}{0,5}=0,5M\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\\ Mol:0,25\leftarrow0,25\\ m_{Mg}=0,25.24=6\left(g\right)\)

Câu 2:
a, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
\(n_{H_2SO_4}=0,5.1=0,5\left(mol\right)\)
PT: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,5}{3}\), ta được H2SO4 dư.
Vậy: Fe2O3 tan hết.
b, Theo PT: \(\left\{{}\begin{matrix}n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,04\left(mol\right)\\n_{H_2SO_4\left(pư\right)}=3n_{Fe_2O_3}=0,12\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,5-0,12=0,38\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Fe_2\left(SO_4\right)_3}}=\dfrac{0,04}{0,5}=0,08\left(M\right)\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,38}{0,5}=0,76\left(M\right)\end{matrix}\right.\)
Câu 3:
a, \(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
\(n_{H_2SO_4}=0,3.0,72=0,216\left(mol\right)\)
PT: \(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_{4\downarrow}+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,216}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow m_{BaSO_4}=0,2.233=46,6\left(g\right)\)
b, Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,216-0,2=0,016\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,016}{0,2+0,3}=0,032\left(M\right)\)
c, - Nhúng quỳ tím vào dd thấy quỳ hóa đỏ do H2SO4 dư.
a) pH= -log[H+]= -log[0,03.2]=1,22
b) nNaOH= 12/40=0,3(mol)
=> [OH-]= [NaOH]=0,3/0,5=0,6(M)
=>pH= 14 + log[0,06]=13,78