Cho 28,4 gam P2O5 tan hết trong 150 gam nước
a) viết PTHH
b) tính nồng độ % chất tan có trong dung dịch thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nMgO=\(\frac{12}{24+16}=0,3\) mol
mHCl = \(\frac{150.14,6}{100}=21,9\)g=> nHCl=\(\frac{21,9}{36,5}=0,6\) mol
PTHH: MgO+2HCl --> MgCl2+ H2O
0,3mol: 0,6mol----->0,3 mol--> ,0,3 mol
mMgCl2=0,3.( 24+35,5.2)=28,5g
theo định luật bảo toàn khối lượng
m MgCl2 =mMgO+mHCl-mH2O=12+150-0,3(1.2+16)=156,6 g
=> C% MgCl2\(=\frac{28,5}{156,6}.100=18,2\)%

\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\\ a,CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ b,n_{H_2SO_4}=n_{CuSO_4}=n_{CuO}=0,1\left(mol\right)\\ C_{MddH_2SO_4}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
c, Cần có thêm KLR của dung dịch axit mới tính được em ha

a, Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a--->2a------------------>a
2Al + 6HCl ---> 2AlCl3 + 3H2
b---->3b-------------------->1,5b
=> \(\left\{{}\begin{matrix}56a+27b=16,6\\a+1,5b=0,5\end{matrix}\right.\Leftrightarrow a=b=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
b) \(C\%_{HCl}=\dfrac{\left(0,2.2+0,2.3\right).36,5}{300}.100\%=12,167\%\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
gọi nFe : a , nAl: b (a,b>0) => 56a + 27b = 16,6 (g)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b \(\dfrac{3b}{2}\)
=> \(a+\dfrac{3b}{2}=0,5\)
ta có hệ pt
\(\left\{{}\begin{matrix}56a+27b=16,6\\a+\dfrac{3b}{2}=0,5\end{matrix}\right.\)
=> a= 0,2 , b = 0,2
\(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=16,6-11,2=5,4\left(g\right)\end{matrix}\right.\)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 0,4
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6
=> \(m_{HCl}=\left(0,4+0,6\right).36,5=36,5\left(g\right)\)
=> \(C\%=\dfrac{36,5}{200}.100\%=18,25\%\)
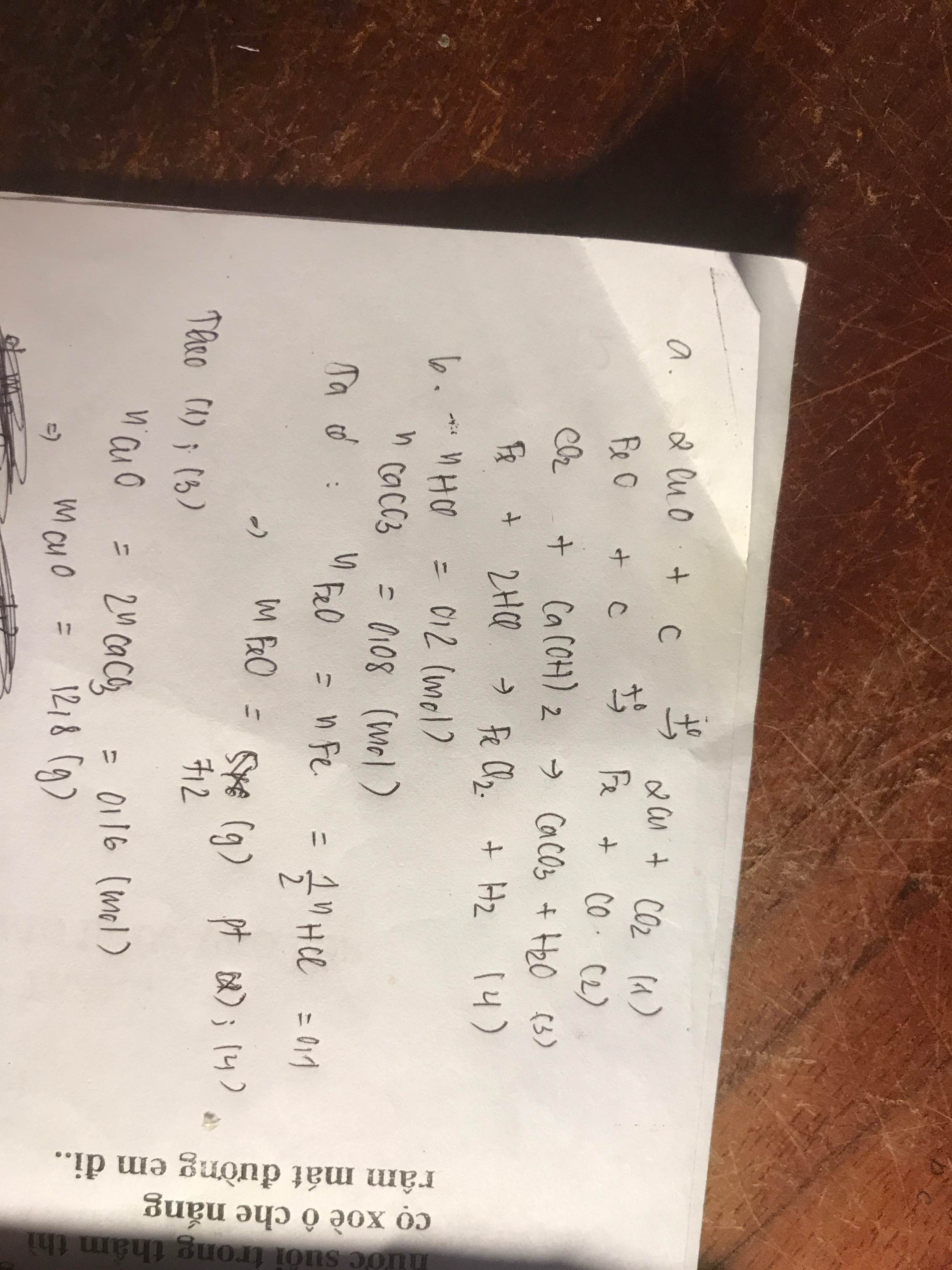
Số mol của đi photpho pentaoxxit
nP2O5 = \(\dfrac{m_{P2O5}}{M_{P2O5}}=\dfrac{28,4}{142}=0,2\left(mol\right)\)
a) Pt : P2O5 + 3H2O → 2H3PO4\(|\)
1 3 2
0,2 0,4
b) Số mol của axit photphoric
nH3PO4 = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit photphoric
mH3PO4 = nH3PO4. MH3PO4
= 0,4 . 98
= 39,2 (g)
Nồng độ phần trăm chất tan của axit photphoric
C0/0H3PO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{39,2.100}{28,4+150}=21,97\)0/0
Chúc bạn học tốt
a) PTHH: P2O5 + 3 H2O -> 2 H3PO4
nP2O5= 28,4/142=0,2(mol)
b) nH3PO4=2.0,2=0,4(mol)
=>mH3PO4=98. 0,4=39,2(g)
mddH3PO4=mP2O5+mH2O=28,4+150=178,4(g)
=>C%ddH3PO4=(39,2/178,4).100=21,973%