Đốt cháy hoàn toàn 3,52g hỗn hợp X, thu được 3,2g sắt (III) oxit và 0,896lit khí sunfuro (đktc). Xác định công thức phân tử của X, biết khối lượng mol của X là 88g/mol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi đốt cháy X thu được F e 2 O 3 và S O 2 nên trong X có Fe, S và có thể có O.
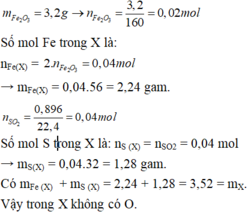
Gọi công thức phân tử hợp chất X có dạng F e x S y
Ta có tỉ lệ:
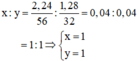
Công thức của hợp chất X là (FeS)n
M F e S n = 88 ⇔ (56 + 32)n = 88 ⇔ n = 1
Vậy công thức hóa học của phân tử X là FeS.

Vì khi đốt cháy hợp chất X thu được sắt oxit và SO2 => các nguyên tố cấu tạo nên hợp chất là Fe và S
gọi CT cả X là 2FexSy --+O2---> xFe2Oy + 2ySO2 (1)
nFexOy= 3,52/88=0,04
theo (1) nSO2=2y/2 *nFexOy=0,896/22,4 => y=1
lại có 56x+32.y=88=>x=1
=> CTPT của X là FeS.

\(n_C=n_{CO_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(n_{H_2O}=\dfrac{2.7}{18}=0.15\left(mol\right)\Rightarrow n_H=0.15\cdot2=0.3\left(mol\right)\)
\(m_O=4.5-0.15\cdot12-0.3=2.4\left(g\right)\)
\(n_O=\dfrac{2.4}{16}=0.15\left(mol\right)\)
\(CT:C_xH_yO_z\)
\(x:y:z=0.15:0.3:0.15=1:2:1\)
\(CTnguyên:\left(CH_2O\right)_n\)
\(M_X=30n=60\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow n=2\)
\(CT:C_2H_4O_2\)
\(CTCT:\)
\(CH_3-COOH\)

Đáp án C
Khí thoát ra khỏi bình là Y ; nCO2 = 0,03 ; nH2O= 0,04
→ Y là ankan → nY = 0,04 - 0,03 = 0,01 → Y là C3H8
Đốt cháy X thu được nCO2 = nH2O
→ nC2H2= nC3H8 = 0,01 mol
→ nC2H4 = ( 0,82 - 0,01 × 26 ) : 28 = 0,02 mol
→ nX = 0,01 + 0,02 + 0,01 = 0,04 → VX = 0,896 (l)

Khí thoát ra khỏi bình là Y; n(CO2) = 0,03 mol; n(H2O) = 0,04 mol
→ Y là ankan → n(Y) = 0,01 → Y là C3H8
Đốt cháy X thu được n(CO2) = n(H2O) → n(C2H2) = n(C3H8) = 0,01 mol
→ n(C2H4) = (0,82 – 0,01*26)/28 = 0,02 mol
→ n(X) = 0,01 + 0,02 + 0,01 = 0,04 → V(X) = 0,896 lít → Đáp án C

a) Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{4,05}{18}=0,45\left(mol\right)\)
Xét mC + mH = 0,15.12 + 0,45 = 2,25 (g)
=> X gồm C và H
b, CTPT của X có dạng CxHy
=> x : y = 0,15 : 0,45 = 1 : 3
=> (CH3)n < 40
=> n = 2
CTPT: C2H6
Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{3,36}{22,4}=0,15mol\)
Bảo toàn H: \(n_H=2.n_{H_2O}=2.\dfrac{4,05}{18}=0,45mol\)
\(n_O=\dfrac{2,25-\left(0,15.12+0,45.1\right)}{16}=0mol\)
=> X chỉ có C và H
\(CTHH:C_xH_y\)
\(\rightarrow x:y=0,15:0,45=1:3\)
\(\rightarrow CTPT:CH_3\)
\(CTĐG:\left(CH_3\right)n< 40\)
\(\rightarrow n=1;2\)
\(n=1\rightarrow CTPT:CH_3\left(loại\right)\)
\(n=2\rightarrow CTPT:C_2H_6\left(nhận\right)\)
\(CTCT:CH_3-CH_3\)

\(=>nSO2=\dfrac{V\left(đktc\right)}{22,4}=\dfrac{0,896}{22,4}=0,04mol\)(khí sunfuro là SO2)
\(=>nS=nSO2=0,04mol=>mS=32.0,04=1,28g\)
\(=>nFe2O3=\dfrac{3,2}{160}=0,02mol=>nFe=2nFe2O3=0,04mol\)
\(=>mFe=2,24g\)
\(=>mS+mFe=2,24+1,28=3,52g=m\left(hh\right)\)
=>hỗn hợp X gồm Fe,S \(=>ct:FexOy\)
\(=>x:y=nFe:nS=0,04:0,04=1:1\)
=> ct thực nhiệm X là \(\left(FeS\right)a\)
theo bài ra \(=>\left(56+32\right)a=88=>a=1\)
=>ct phân tử của X là FeS