Cho 12,3g một hỗn hợp gồm FeO và Al2O3 tác dụng vừa đủ với 250ml dung dịch axit HCL 2(M) , Thì thu dung dịch chứa 2 muối
a) Xác dịnh thành phần % về khối lượng mỗi oxit trong hỗn hợp đầu
b) Tìm khối lượng muối
b) Tìm nồng độ các muối trong dung dịch
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

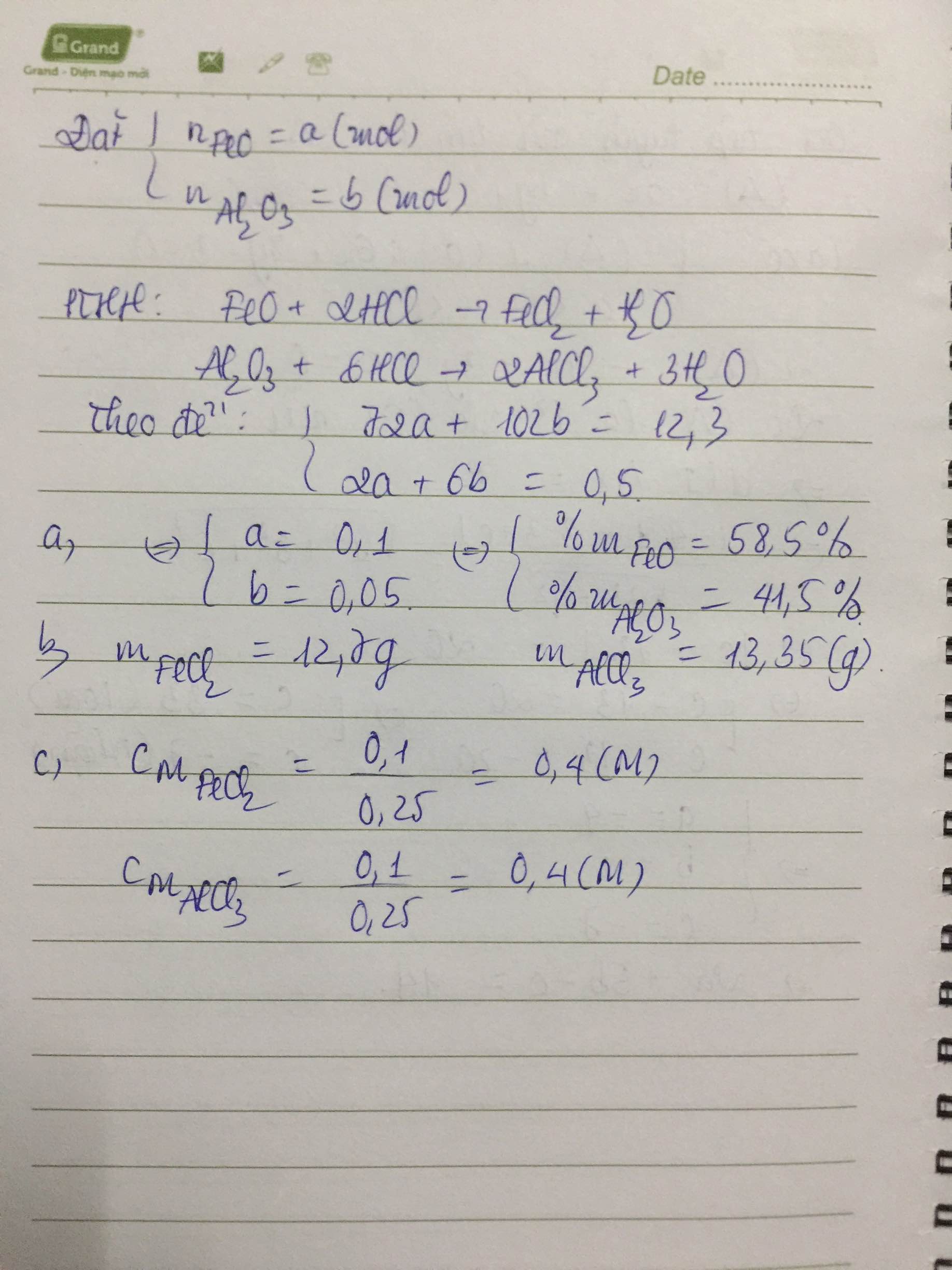


PTHH: \(FeO+2HCl\rightarrow FeCl_2+H_2O\)
x______2x______x______x (mol)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
y______6y______2y_______3y (mol)
a) Ta lập HPT: \(\left\{{}\begin{matrix}72x+102y=12,3\\2x+6y=0,25\cdot2=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeO}=\dfrac{0,1\cdot72}{12,3}\cdot100\%\approx58,54\%\\\%m_{Al_2O_3}=41,46\%\end{matrix}\right.\)
b) Theo PTHH: \(n_{FeCl_2}=0,1\left(mol\right)=n_{AlCl_3}\)
\(\Rightarrow m_{muối}=0,1\cdot127+0,1\cdot133,5=26,05\left(g\right)\)

\(n_{MgO}=a\left(mol\right),n_{Fe_2O_3}=b\left(mol\right)\)
\(m=40a+160b=12\left(g\right)\left(1\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(m_{Muối}=120a+400y=32\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\%MgO=\dfrac{0.1\cdot40}{12}\cdot100\%=33.33\%\)
\(\%Fe_2O_3=66.67\%\)
\(m_{dd}=12+200=212\left(g\right)\)
\(C\%_{MgSO_4}=\dfrac{0.1\cdot120}{212}\cdot100\%=5.66\%\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0.05\cdot400}{212}\cdot100\%=9.42\%\)

Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
a 2a 0,1
Fe2O3 + 6HCl → 2FeCl3 + 3H2O\(|\)
1 6 2 3
b 6b 0,1
a) Theo đề ta có : mCuO + mFe2O3 = 16 (g)
⇒ nCuO . MCuO + nFe2O3 . MFe2O3 = 16 g
⇒ 80a + 160b = 16 g (1)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{10.182,5}{100}=18,25\left(g\right)\)
Số mol của axit clohidirc
nHCl =\(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
⇒ 2a + 6b = 0,5 (2)
Từ (1),(2) , ta có hệ phương trình :
80a + 160b = 16
2a + 6b = 0,5
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
Khối lượng của đồng (II) oxit
mCuO = nCuO . MCuO
= 0,1 . 80
= 8 (g)
Khối lượng của sắt (III) oxit
mFe2O3 = nFe2O3 . MFe2O3
= 0,05 . 160
= 8 (g)
0/0CuO = \(\dfrac{m_{CuO}.100}{m_{hh}}=\dfrac{8.100}{16}=50\)0/0
0/0Fe2O3 = \(\dfrac{m_{Fe2O3}.100}{m_{hh}}=\dfrac{8.100}{16}=50\)0/0
b) Có nCuO = 0,1 mol ⇒ nCuCl2 = 0,1 mol
nFe2O3 = 0,05 mol ⇒ nFeCl3 = 0,1 mol
Khối lượng của muối đồng (II) clorua
mCuCl2 = nCuCl2 . MCuCl2
= 0,1 . 135
= 13,5 (g)
khối lượng của muối sắt (III) clorua
mFeCl3 = nFeCl3 . MFeCl3
= 0,1 . 162,5
= 16,25 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = (mCuO + mFe2O3) + HCl
= 16 + 182,5
= 198,5 (g)
Nồng độ phàn trăm của muối đồng (II) clorua
C0/0CuCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{13,5.100}{198,5}=6,80\)0/0
Nồng đọ phàn trăm của muối sắt (III) clorua
C0/0FeCl3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{16,25.100}{198,5}=8,19\)0/0
Chúc bạn học tốt

\(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
Fe + H2SO4 → FeSO4 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Gọi x,y lần lượt là số mol Fe, Al
\(\left\{{}\begin{matrix}56x+27y=11\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=>\(\%m_{Fe}=\dfrac{0,1.56}{11}.100=50,91\%\)
=> %m Al = 100 - 50,91 =49,09 %
b)Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,4\left(mol\right)\)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
c) \(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
\(CM_{Al_2\left(SO_4\right)_3}=\dfrac{\dfrac{0,2}{2}}{0,2}=0,5M\)

PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a_______a_______a_____a (mol)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
2b______3b__________b_____3b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27\cdot2b=11\\a+3b=0,2\cdot2=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{11}\cdot100\%\approx50,91\%\\\%m_{Al}=49,09\%\end{matrix}\right.\)
Theo các PTHH: \(\left\{{}\begin{matrix}n_{H_2}=0,4\left(mol\right)\\n_{FeSO_4}=0,1\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)
a) nH2SO4=0,4(mol)
Đặt: nFe=x(mol); nAl=y(mol) (x,y>0)
PTHH: Fe + H2SO4 -> FeSO4 + H2
x________x______x______x(mol)
2Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
y____1,5y_______0,5y_______1,5y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}56x+27y=11\\x+1,5y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> mFe=0,1.56=5,6(g)
=>%mFe=(5,6/11).100=50,909%
=>%mAl= 49,091%
b) V(H2,đktc)=0,4.22,4=8,96(l)
c) nAl2(SO4)3= 0,5y=0,5.0,2=0,1(mol)
nFeSO4=x=0,1(mol)
Vddsau=VddH2SO4=0,2(l)
=>CMddAl2(SO4)3= 0,1/0,2=0,5(M)
CMddFeSO4=0,1/0,2=0,5(M)

Gọi x,y lần lượt là số mol Al2O3, CuO
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
CuO + H2SO4 → H2O + CuSO4
\(\left\{{}\begin{matrix}102x+80y=12,3\\3x+y=\dfrac{100.24,5\%}{98}=0,25\end{matrix}\right.\)
=> x= 0,056; y=0,082
=> \(\%m_{Al_2O_3}=\dfrac{0,056.102}{12,3}.100=46,44\%\)
=> %mCuO= 100 - 46,44= 53,56%
b)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
CuO + 2HCl → CuCl2 + H2O
=> \(m_{HCl}=\dfrac{(0,056.6+0,082.2).36,5}{7\%}=260,7\%\)

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a______a____a (mol)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
b_____2b_______b____b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}56a+24b=10,4\\a+b=\dfrac{6,72}{22,4}=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{10,4}\cdot100\%\approx53,85\%\\\%m_{Mg}=46,15\%\\C_{M_{FeCl_2}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{MgCl_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\end{matrix}\right.\)