10. Cho 28,4g điphotpho pentaoxit P2O5 vào cốc chứa 90g nước để tạo thành axit photphoric. Tinh khối lượng axit H3PO4 được tạo thành ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phương trình phản ứng:
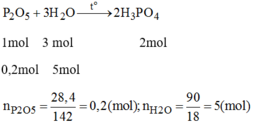
Tỉ lệ mol:
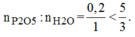
Vậy H 2 O dư và P 2 O 5 hết.
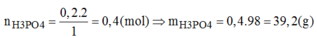
→ Chọn C.

1)
nH2 = 2/2 = 1 (mol)
nO2 = 1.12/22.4 = 0.05 (mol)
2H2 + O2 -to-> 2H2O
0.1_____0.05____0.1
mH2O = 0.1*18 = 1.8 (g)
2)
nS = 3.2/32 = 0.1 (mol)
nO2 = 1.12/22.4 = 0.05 mol
S + O2 -to-> SO2
0.05_0.05____0.05
VSO2 = 0.05*22.4 = 1.12 (l)
3)
nP2O5 = 28.4/142 = 0.2 (mol)
nH2O = 90/18 = 5 (mol)
P2O5 + 3H2O => 2H3PO4
0.2_____0.6________0.4
mH3PO4 = 0.4*98 = 39.2 (g)
4)
nkk = 125.776/22.4 = 5.615 (mol)
nO2 = 5.615/5 = 1.123 (mol)
Mg + 1/2O2 -to-> MgO
2.246___1.123
mMg = 2.246*24 = 53.904 (g)
Chúc bạn học tốt !!

Ta có: \(n_{P_2O_5}=\dfrac{1,42}{142}=0,01\left(mol\right)\)
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
___0,01_____________0,02 (mol)
\(\Rightarrow m_{H_3PO_4}=0,02.98=1,96\left(g\right)\)
Bạn tham khảo nhé!

\(n_P=\dfrac{6,2}{31}=0,2mol\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
Xét: \(\dfrac{0,2}{4}\) < \(\dfrac{0,3}{5}\) ( mol )
0,2 0,1 ( mol )
\(m_{P_2O_5}=0,1.142=14,2g\)
`PTHH: 4P + 5O_2` $\xrightarrow[]{t^o}$ `2P_2 O_5`
`n_P = [ 6,2 ] / 31 = 0,2 (mol)`
`n_[O_2] = [ 6,72 ] / [ 22,4 ] = 0,3 (mol)`
Ta có: `[ 0,2 ] / 4 < [ 0,3 ] / 5`
`->P` hết ; `O_2` dư
Theo `PTHH` có: `n_[P_2 O_5] = 1 / 2 n_P = 1 / 2 . 0,2 = 0,1 (mol)`
`-> m_[P_2 O_5] = 0,1 . 142 = 14,2 (g)`

Khối lượng khí Oxi đã phản ứng là:
mP2O5 = mP + mO2
28,4 = 12,4 + mO2
mO2 = 28,4 - 12,4
mO2 = 16 g

PTHH:P2O5+3H2O\(\underrightarrow{t^0}\)2H3PO4
Theo PTHH:142 gam P2O5 cần 54 gam H2O
Vậy:7,1 gam P2O5 cần 2,7 gam H2O
Do đó:P2O5 thừa:28,4-7,1=21,3(gam)
Vì P2O5 thừa nên ta tính SP theo chất thiếu là:H2O
Theo PTHH:54 gam H2O tạo ra 196 gam H3PO4
Vậy:2,7 gam H2O tạo ra 9,8 gam H3PO4
Vậy mH3PO4=9,8 gam
Ta có: \(n_{P_2O_5}=\frac{28,4}{142}=0,2\left(mol\right)\\ n_{H_2O}=\frac{2,7}{18}=0,15\left(mol\right)\)
PTHH: P2O5 + 3H2O -to-> 2H3PO4
Theo PTHH và đề bài, ta có:
\(\frac{0,2}{1}>\frac{0,15}{3}\)
=> P2O5 dư, H2O hết nên tính theo \(n_{H_2O}\)
Theo PTHH và đề bài, ta có:
\(n_{H_3PO_4}=\frac{2.0,15}{3}=0,1\left(mol\right)\)
Khối lượng H3PO4 tạo thành sau phản ứng:
\(m_{H_3PO_4}=0,1.98=9,8\left(g\right)\)


$n_{P_2O_5} = 0,2(mol) ; n_{H_2O} = 5(mol)$
$P_2O_5 + H_2O \to 2H_3HO_4$
Ta thấy : $n_{P_2O_5} < n_{H_2O}$ nên $H_2O$ dư
$n_{H_3PO_4} = 2n_{P_2O_5} = 0,4(mol)$
$m_{H_3PO_4} = 0,4.98 = 39,2(gam)$
\(n_{P_2O_5}=\dfrac{28.4}{142}=0.2\left(mol\right)\)
\(n_{H_2O}=\dfrac{90}{18}=5\left(mol\right)\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(1.........3\)
\(0.2..........5\)
\(LTL:\dfrac{0.2}{1}< \dfrac{5}{3}\Rightarrow H_2Odư\)
\(m_{H_3PO_4}=0.2\cdot2\cdot98=39.2\left(g\right)\)