Trình bày tính chất hóa học của nước và viết các phương trình hóa học minh họa
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


b. Tính chất hóa học của nước
- Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
- Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
- Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
- Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
- Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
-Tác dụng với một số oxit axit tạo thành axit
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
-Tác dụng với một số oxit bazơ tạo hành bazơ
\(Na_2O+H_2O\rightarrow2NaOH\)
-Tác dụng với một số kim loại ở nhiệt độ thường tạo thành bazơ và khí H2
\(2K+2H_2O\rightarrow2KOH+H_2\)

- Tác dụng với kim loại:
Nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
- Tác dụng với một số oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
\(K_2O+H_2O\rightarrow2KOH\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
- Tác dụng với oxit axit như SO3, P2O5… tạo thành axit tương ứng H2SO4, H3PO4,…
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)

I.Khái niệm và phân loại
-Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (OH).
-Hóa trị của kim loại bằng số nhóm hidroxit
-Tên bazơ = tên kim loại (thêm hóa trị, nếu kim loại có nhiều hóa trị) + hidroxit
Ví dụ: NaOH: Natri hidroxit
Fe(OH)3: Sắt (III) hidroxit
-Dựa vào tính tan của bazơ trong nước, người ta chia bazơ thành 2 loại:
+ Bazơ tan được trong nước tạo thành dung dịch bazơ (gọi là kiềm):
Ví dụ: NaOH, KOH, Ba(OH)2, Ca(OH)2, LiOH, RbOH, CsOH, Sr(OH)2.
+ Những bazơ không tan:
Ví dụ: Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3…
II. Tính chất hóa học
1) Tác dụng với chất chỉ thị màu.
- Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
- Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
2) Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
3) Bazơ (tan và không tan) tác dụng với axit tạo thành muối và nước.
Ví dụ: KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
4) Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Lưu ý: Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
5) Bazơ không tan bị nhiệt phân hủy thành oxit và nước

Trích mẫu thử các lọ dung dịch, đánh số thứ tự để thuận tiện đối chiếu kết quả.
5 dung dịch: C2H5OH, CH3COOC2H5, C6H6, CH3COOH, C6H12O6.
Pt:
CH3COOH + NaHCO3 → CH3COONa + CO2↑ + H2O
2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu(xanh lam) + 2H2O
C2H5OH + Na → C2H5ONa + ½ H2

Dùng quỳ tím:
+ Chuyển màu là \(H_2SO_4,HCl\)
+ Không chuyển màu là nước cất
Dùng \(BaCl_2\):
+ Tạo phản ứng kết tủa: \(H_2SO_4\)
+ Không phản ứng: \(HCl\)
\(PTHH:H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\)

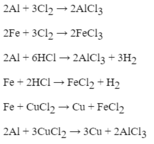

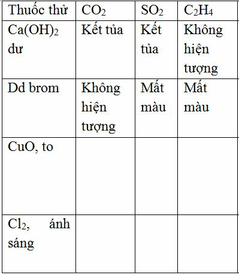
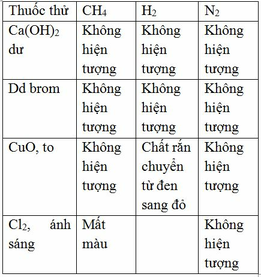
Tính chất hóa học của nước :
Nước có thể tác dụng với một số kim loại ở nhiệt độ thường :
Pt : Ca + 2H2O \(\rightarrow\) Ca(OH)2 + H2
Na + 2H2O \(\rightarrow\) 2NaOH + H2
Tác dụng với oxit bazo :
Pt : CaO + H2O \(\rightarrow\) Ca(OH)2
K2O + H2O \(\rightarrow\) 2KOH
Tác dụng với oxit axit
Pt : SO3 + H2O \(\rightarrow\) H2SO4
P2O5 + 3H2O \(\rightarrow\) 2H3PO4
Chúc bạn học tốt
Tính chất hh của nước:
✱Tác dụng với kim loại:
VD: Na + H2O → NaOH + \(\dfrac{1}{2}\)H2↑
Ca + 2 H2O → CaOH + H2↑
✱Tác dụng với oxit bazơ:
VD: K2O + H2O → KOH
BaO + H2O → Ba(OH)2
✱Tác dụng với oxit axit:
VD: CO2 + H2O → H2CO3
SO2 + H2O → H2SO3