Cho 5,04 gam Fe tác dụng với H2SO4 đặc, nóng sau khi các phản ứng xẩy ra hoàn, thu được 2,688 lít khí SO2 đktc duy nhất và dung dịch X. Để phản ứng hết các chất trong dung dịch X cần dùng m gam Cu. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
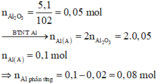
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
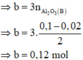
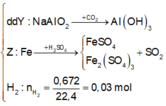
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
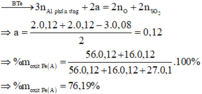

Đáp án : C
P1 : nH2 = nFe = 0,1 mol
P2 : Gọi số mol của Fe và Cu trong P2 lần lượt là x và y
=> bảo toàn e : 3x + 2y = 2nSO2 = 0,8 mol
, mmuối = mCuSO4 + mFe2(SO4)3 = 200x + 160y = 56g
=> x = 0,2 ; y = 0,1 mol
Tỉ lệ mol Fe : Cu trong các phần không đổi
=>Trong P1 : nCu = 0,05 mol
Trong m gam X có: 0,3 mol Fe và 0,15 mol Cu
=> m = 26,4g

Đáp án B.
![]()
Giả sử Z + H2SO4 → dung dịch muối tạo thành chỉ có Fe2(SO4)3:
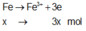
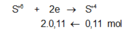
![]()
![]()
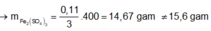
→ muối thu được gồm FeSO4 và Fe2(SO4)3.
Ta có sơ đồ phản ứng:
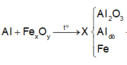
→ + N a O H d ư

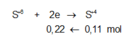
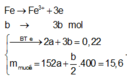
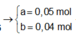
![]()
X tác dụng được với dung dịch NaOH tạo khí H2 →Al dư.
![]()
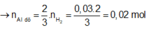
![]()
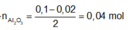
![]()
![]()
![]()
![]()

Sau phản ứng có Al dư do phản ứng với NaOH tạo H2
=> nAl dư = 2/3 .nH2 = 0,02 mol
Sau phản ứng có Al và Al2O3 + NaOH => NaAlO2
Bảo toàn Al ta có :
2nAl2O3 sau nung= nAl dư + 2nAl2O3 => nAl2O3 = 0,04 mol
=>nAl ban đầu = 0,1 mol
Do các phản ứng hàn toàn , mà khi nhiệt nhôm Al dư => oxit sắt hết
=>D chỉ có Fe
=>Bảo toàn e : 3nFe = 2nSO2 => nFe = 0,08 mol
Bảo toàn khối lượng : mA = mB = mFe + mAl + mAl2O3 = 9,1g
=>%mAl(A) = 29,67% gần nhất với giá trị 24%
=>A
PTHH: \(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3O_2\uparrow+6H_2O\)
\(n_{SO_2}=\frac{2,688}{22,4}=0,12mol\) và \(n_{Fe}=\frac{5,04}{56}=0,09mol\)
\(X:Fe_2\left(SO_4\right)_3\)
Theo phương trình \(n_{Fe_2\left(SO_4\right)_3}=\frac{1}{3}n_{SO_2}=0,04mol\)
PTHH: \(Cu+Fe_2\left(SO_4\right)_3\rightarrow2FeSO_4+CuSO_4\)
Theo phương trình \(n_{Fe}=n_{Fe_2\left(SO_4\right)_3}=0,04mol\)
\(\rightarrow m_{Cu}=0,04.64=2,56g\)