Cho 0,845 gam hỗn hợp bột mg, fe, zn vào dd hcl dư và lắc cho đến phản ứng kết thúc thấy thoát ra 448ml khí(đktc). Cô cạn hỗn hợp sau phản ứng thì thu được bao nhiêu gam muối khan?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phản ứng xảy ra:
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có :
\(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)\)
\(\Rightarrow n_{HCl}=2n_{H2}=0,04\left(mol\right)\)
Cô cạn dung dịch thì rắn thu được là các muối.
BTKL:
\(m_{kl}+m_{HCl}=m_{muoi}+m_{H2}\)
\(\Rightarrow m_{muoi}=0,845+0,04.36,5-0,02.2=2,265\left(g\right)\)

Coi hỗn hợp kim loại trên là R có hóa trị n
\(4R + nO_2 \xrightarrow{t^o} 2R_2O_n\\ m_{O_2} = 17-10,2 = 6,8(gam) \Rightarrow n_{O_2} = \dfrac{6,8}{32} = 0,2125(mol)\\ n_R = \dfrac{4}{n}n_{O_2} = \dfrac{0,85}{n}(mol)\\ 2R + 2nHCl \to 2RCl_n + nH_2\\ n_{H_2} = \dfrac{n}{2}n_R = 0,425(mol)\\ \Rightarrow V = 0,425.22,4 = 9,52(lít)\\ n_{HCl} = 2n_{H_2} = 0,85(mol)\\ \text{Bảo toàn khối lượng : }\\ m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 10,2 + 0,85.36,5 - 0,425.2 = 40,375(gam)\)

nSO2= 0,15(mol)
PTHH: Mg + 2 H2SO4(đ) -to> MgSO4 + SO2 + 2 H2O
x________2x______________x_______x(mol)
2 Fe + 6 H2SO4(Đ) -to-> Fe2(SO4)3 + 3 SO2 +6 H2O
y____3y__________0,5y___________1,5y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24x+56y=5,2\\x+1,5y=0,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,03\\y=0,08\end{matrix}\right.\)
=> m(muối)= mMgSO4+ mFe2(SO4)3= 120.x+0,5.y.400=120.0,03+0,5.0,08.400=19,6(g
=>CHỌN B

a)
$4Na + O_2 \xrightarrow{t^o} 2Na_2O$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$2Na + 2HCl \to 2NaCl + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
b)
Bảo toàn khối lượng : $m_{O_2} = 4,08 - 2,48 = 1,6(gam)$
$n_{O_2} = \dfrac{1,6}{32} = 0,05(mol)$
Đốt 2,48 gam X cần 0,05 mol $O_2$
Suy ra, đốt 4,96 gam X cần 0,1 mol $O_2$
Mà : \(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}=n_{O_2}=0,1\)
Theo PTHH :
\(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Mg}+\dfrac{3}{2}n_{Al}=2\left(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}\right)=2.0,1=0,2\)$V = 0,2.22,4 = 4,48(lít)$
$n_{HCl} = 2n_{H_2} = 0,4(mol)$
Bảo toàn khối lượng : $m = 4,96 + 0,4.36,5 - 0,2.2 = 19,16(gam)$

Chọn đáp án C
11,03 gam 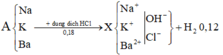
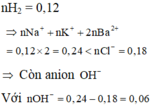
⇒ mRắn = 11,03+0,18.35,5+0,06.17 = 18,44 gam
\(n_{H_2}=\dfrac{0.448}{22.4}=0.02\left(mol\right)\)
\(\Rightarrow n_{HCl}=2n_{H_2}=2\cdot0.02=0.04\left(mol\right)\)
\(BTKL:\)
\(m_{Muối}=0.845+0.04\cdot36.5-0.02\cdot2=2.265\left(g\right)\)