Để 8,4g sắt ngoài không khí sau mọt thời gian thu đc 10g chất rắn X . Hòa tan hoàn toàn X bởi dd H2SO4 đ,n,dư được V lít khí SO2 (đktc, sp khử duy nhất của S+6 ). Tính V ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Ta có: = 0,145 mol
Quy đổi 20,88 g oxit sắt FexOy thành 20,88 g Fe và O
Gọi nFe = x mol; nO = y mol
Quá trình nhường electron:
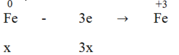
Quá trình nhận electron:
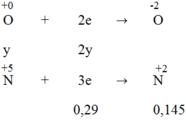
Áp dụng định luật bảo toàn electron, ta có:
3x = 2y + 0,29 → 3x - 2y = 0,29 (1)
Mặt khác: 56x + 16y = 20,88 (2)
Từ (1) và (2) → x = 0,29 và y = 0,29
Muối sinh ra là muối Fe2(SO4)3. Áp dụng ĐL bảo toàn nguyên tố ta có:
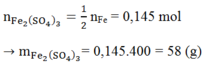

Đáp án C
Ta có: nCO = 0,8 mol; = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n ≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron.
H2SO4 đặc là chất oxi hóa nhận electron:

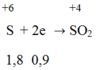
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
nO (trong oxit) = nCO = 0,8 mol
⇒Tỉ lệ:
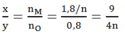
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3


Đáp án C
Gọi a, b là số mol CuO và FexOy, viết sơ đồ phản ứng ta có:
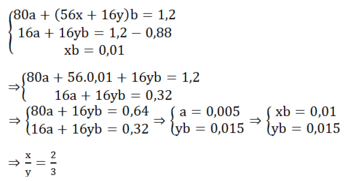

Đáp án A
Quy hỗn hợp X về 2 chất Fe và Fe2O3
Hòa tan hỗn hợp X vào dung dịch HNO3 dư ta có:

⇒Số mol nguyên tử Fe trong oxit Fe2O3 là:
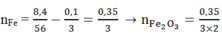
Vậy:
![]()
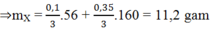

Coi hỗn hợp Y gồm : Kim loại và Oxi
$n_O = \dfrac{2,71-2,23}{16}= 0,03(mol)$
Gọi $n_{H_2SO_4\ pư}= a(mol)$
$n_{SO_2} = \dfrac{1,008}{22,4} = 0,045(mol)$
Bảo toàn nguyên tố với H : $n_{H_2O} = n_{H_2SO_4\ pư} = a(mol)$
Bảo toàn nguyên tố với S :
$n_{SO_4(trong\ muối)} = n_{H_2SO_4} - n_{SO_2} = a - 0,045(mol)$
Bảo toàn nguyên tố với O :
$0,03 + 4a = (a - 0,045).4 + 0,045.2 + a$
$\Rightarrow a = 0,12(mol)$
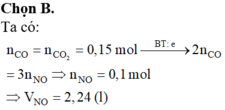

Ta có: mO (trong oxit) = 10 - 8,4 = 1,6 (g)
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Giả sử: \(n_{SO_2}=x\left(mol\right)\)
Theo ĐLBT mol e, có: 0,15.3 = 0,1.2 + 2x
⇒ x = 0,125 (mol)
\(\Rightarrow V_{SO_2}=0,125.22,4=2,8\left(l\right)\)
Bạn tham khảo nhé!
\(n_{Fe}=\dfrac{8.4}{56}=0.15\left(mol\right)\)
\(m_{O_2}=10-8.4=1.6\left(g\right)\)
\(n_{O_2}=0.1\left(mol\right)\)
Bảo toàn e :
\(n_{SO_2}=\dfrac{3\cdot0.15+0.1\cdot4}{2}=0.425\left(mol\right)\)
\(V_{SO_2}=0.425\cdot22.4=9.52\left(l\right)\)