1) Đốt cháy hh gồm 9,75gam Zn và 3,84gam S trong một bình kín .thu dc chất rắn X(Zn=65;S=32) a) tính khối lượng các chất có trong chất rắn X b) cho X tác dụng vừa đủ với dd HCl thu dc V(1)(đkc) khí A .tìm giá trị của V Mn giúp e với ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Gọi số mol Al, Zn là 2a, a (mol)
PTHH: 4Al + 3O2 --to--> 2Al2O3
2a-->1,5a---------->a
2Zn + O2 --to--> 2ZnO
a---->0,5a------->a
=> \(102a+81a=18,3\)
=> a = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{0,2.27+0,1.65}.100\%=45,378\%\\\%m_{Zn}=\dfrac{0,1.65}{0,2.27+0,1.65}.100\%=54,622\%\end{matrix}\right.\)
b) \(n_{O_2}=1,5a+0,5a=0,2\left(mol\right)\)
=> \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)

1./ Dẫn luồng khí H2 qua ống đựng CuO:
CuO + H2 → Cu + H2O
a a a
Khối lượng chất rắn giảm:
Δm = m(CuO pư) - m(Cu) = 80a - 64a = 80 - 72,32 = 7,68g
⇒ a = 7,68/16 = 0,48g
Số mol H2 tham gia pư: n(H2) = 0,48/80% = 0,6mol
Theo ĐL bảo toàn nguyên tố, số mol HCl tham gia pư là: n(HCl pư) = 2.n(H2) = 1,2mol
Theo ĐL bảo toàn khối lượng:
m(hh rắn) + m(HCl pư) = m(muối) + m(H2) ⇒ m(muối) = m(hh rắn) + m(HCl pư) - m(H2)
⇒ m(muối) = 65,45 + 0,12.36,5 - 0,6.2 = 108,05g
Gọi x, y là số mol Al và Zn có trong hh KL ban đầu.
m(hh KL) = m(Al) + m(Zn) = 27x + 65y = 40,6g
m(muối) = m(AlCl3) + m(ZnCl2) = 133,5x + 136y = 108,05g
⇒ x = 0,3mol và y = 0,5mol
Khối lượng mỗi kim loại:
m(Al) = 0,3.27 = 8,1g; m(Zn) = 65.0,5 = 32,5g
Thành phần % khối lượng mỗi kim loại:
%Al = 8,1/40,6 .100% = 19,95%
%Zn = 32,5/40,6 .100% = 80,05%

Ta quy đổi 3kl trên thành A vì nó có cùng hóa trị, ta được:
A + (1/2)O2 -> AO
AO + 2HCl -> ACl2 +H2O
Rồi ta dùng bảo toàn khối lượng:
m(A)=34.5-0.2*32=28.1


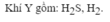
a)
$Zn + S \xrightarrow{t^o} ZnS$
$n_{Zn} =\dfrac{9,75}{65} = 0,15 > n_S = \dfrac{3,84}{32} = 0,12$ nên Zn dư
$n_{ZnS} = n_S = 0,12(mol)$
$m_{ZnS} = 0,12.97 = 11,64(gam)$
$n_{Zn\ dư} = 0,15 - 0,12 = 0,03(mol)$
$m_{Zn\ dư} = 0,03.65 = 1,95(gam)$
b)
$Zn + 2HCl \to ZnCl_2 + H_2$
$ZnS + 2HCl \to ZnCl_2 + H_2S$
$n_{khí} = n_{H_2} + n_{H_2S} = n_{Zn\ dư} + n_{ZnS} = 0,15(mol)$
$V = 0,15.22,4 = 3,36(lít)$
\(n_{Zn}=\dfrac{9.75}{65}=0.15\left(mol\right)\)
\(n_S=\dfrac{3.84}{32}=0.12\left(mol\right)\)
\(Zn+S\underrightarrow{^{^{t^0}}}ZnS\)
Lập tỉ lệ :
\(\dfrac{0.15}{1}>\dfrac{0.12}{1}\Rightarrow Zndư\)
\(a.\)
\(m_X=m_{ZnS}+m_{Zn\left(dư\right)}=0.12\cdot97+\left(0.15-0.12\right)\cdot65=13.59\left(g\right)\)
\(b.\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.03..................................0.03\)
\(ZnS+2HCl\rightarrow ZnCl_2+H_2S\)
\(0.12.................................0.12\)
\(V_{khí}=0.03\cdot22.4+0.12\cdot22.4=3.36\left(l\right)\)