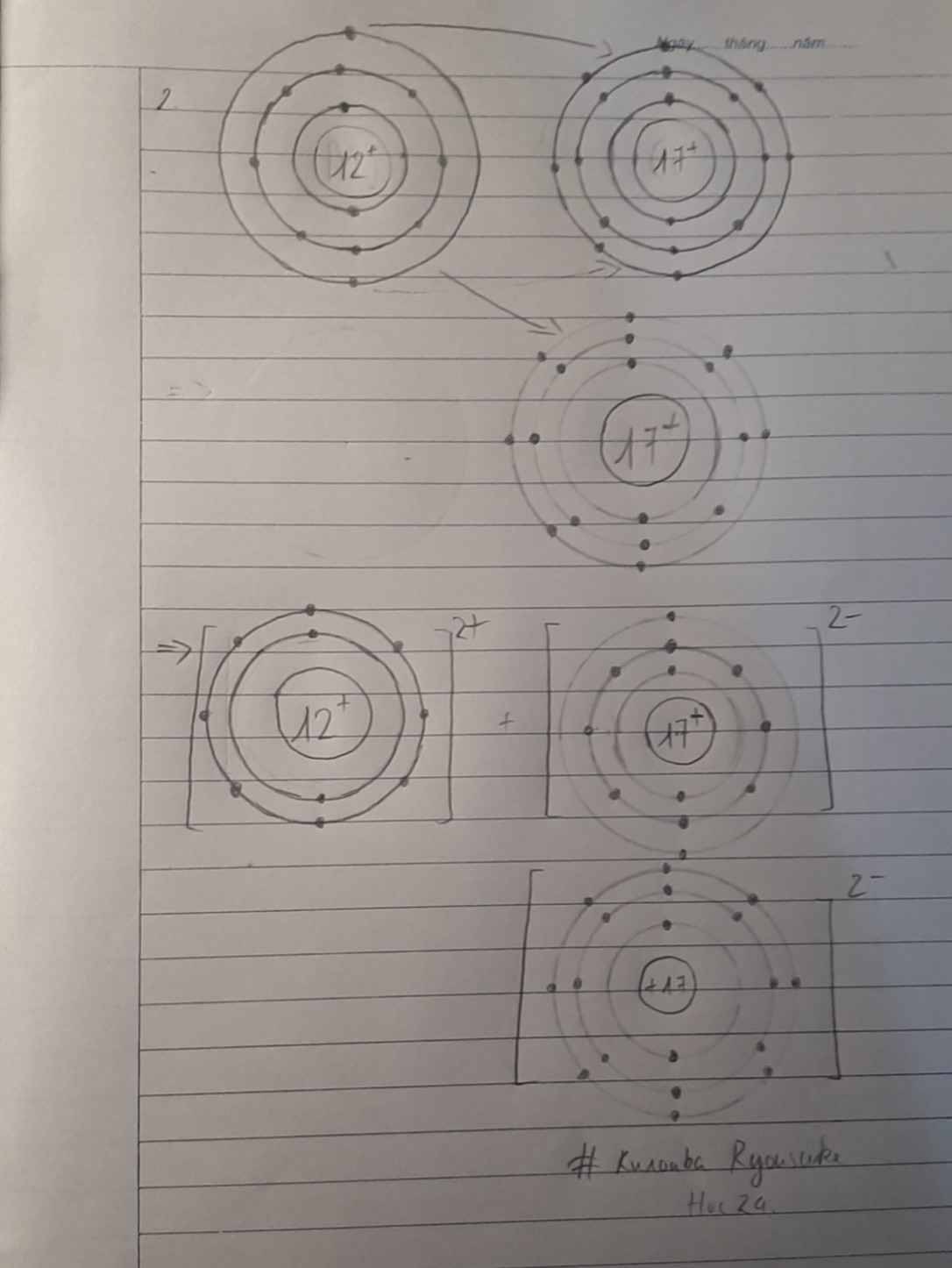
Vẽ sơ đồ tạo thành liên kết ion trong phân tử magnesium oxide?Biết Mg=12p;O=8p
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


tham khảo
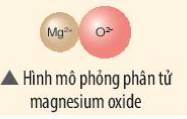
- Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+
- Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2-
=> Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
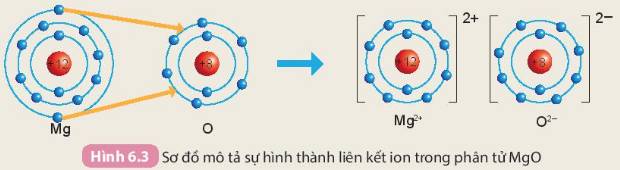
- Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide:
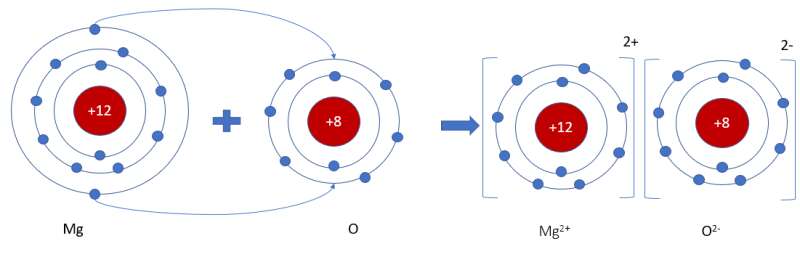

Khi hình thành phân tử `MgO,` các nguyên tử đã có sự nhường nhận `e` như sau:
`-` Nguyên tử `Mg` nhường `2e` ở lớp ngoài cùng cho nguyên tử `O` để tạo thành ion dương \(Mg^{2+}\) có vỏ bền vững giống khí hiếm `Ne`.
`-` Nguyên tử `O` nhận `2e` vào lớp ngoài cùng từ nguyên tử `Mg` để tạo thành ion âm \(O^{2-}\) có vỏ bền vừng giống khí hiếm `Ne`.
Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử `MgO`.

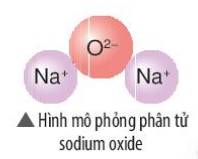
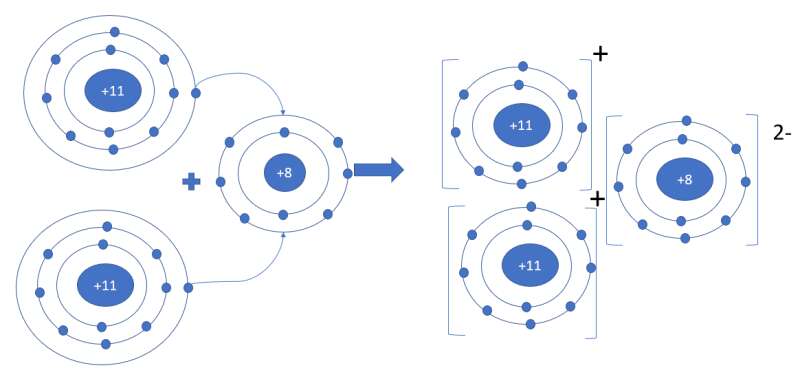
- Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim)
=> Liên kết ion
- Nguyên tử Na (số hiệu nguyên tử = 11) nhường 1 electron => Ion Na+
- Nguyên tử O (số hiệu nguyên tử = 8) nhận 2 electron => Ion O2-

- Ca có 2 electron ở lớp ngoài cùng (giống như nguyên tử Mg) => Dễ dàng cho đi 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
- O có 6 electron ở lớp ngoài cùng => Dễ dàng nhận thêm 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
Cái sơ đồ em vẽ vòng e của 2 nguyên tử dùng dấu + xong -> thành 2 vòng e các nguyên tử sát nhau

Vì mỗi nguyên tử N đều có 5 electron ở lớp vỏ ngoài cùng => Cần nhận thêm 3 electron vào lớp vỏ ngoài cùng để có lớp vỏ electron bền vững tương tự khí hiếm
=> Khi 2 nguyên tử N liên kết với nhau, mỗi nguyên tử sẽ góp 3 electron ở tạo ra 3 đôi electron dùng chung

Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Từ đây em tự vẽ khi mỗi nguyên tử góp 1e dùng chung