Một hợp chất có khối lượng mol bằng 385g/mol, trong đó Zn= 50,65%; P = 16,1%, còn lại là O. Xác định CTHH của hợp chất.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\%O=100-50.65-16.1=33.25\%\)
CTHH là : \(Zn_xP_yO_z\)
\(\%Zn=\dfrac{65x}{385}\cdot100\%=50.65\%\)
\(\Rightarrow x=3\)
\(\%P=\dfrac{31y}{385}\cdot100\%=16.1\%\)
\(\Rightarrow y=2\)
\(M=65\cdot3+31\cdot2+16z=385\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow z=8\)
\(CTHH:Zn_3\left(PO_4\right)_2\)

%Cl = 100% - 39,32% = 60,68%
Gọi CTHH của A là $Na_xCl_y$
Ta có :
$\dfrac{23x}{39,32} = \dfrac{35,5y}{60,68} = \dfrac{58,5}{100}$
Suy ra : $x = 1 ; y = 1$
Vậy CTHH của hợp chất là NaCl
\(m_{Na}=\%Na.M_A=39,32\%.58,5=23\left(g\right)\\ m_{Cl}=m_A-m_{Na}=58,5-23=35,5\left(g\right)\\ \Rightarrow n_{Na}=\dfrac{23}{23}=1\left(mol\right)\\ n_{Cl}=\dfrac{35,5}{35,5}=1\left(mol\right)\\ CTHH:NaCl\)

Bài 1 :
Giả sử : hỗn hợp có 1 mol
\(n_{H_2}=a\left(mol\right),n_{O_2}=1-a\left(mol\right)\)
\(\overline{M_X}=0.3276\cdot29=9.5\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow m_X=2a+32\cdot\left(1-a\right)=9.5\left(g\right)\)
\(\Rightarrow a=0.75\)
Cách 1 :
\(\%H_2=\dfrac{0.75}{1}\cdot100\%=75\%\)
\(\%O_2=100-75=25\%\)
Cách 2 em tính theo thể tích nhé !

Khối lượng riêng của chất đó là: D = m/v = 13000 : 5 = 2600 (kg/m3)
Chất có D bằng 2600kg/m3 là đá.
Vậy vật đó làm bằng đá.
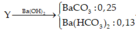
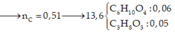
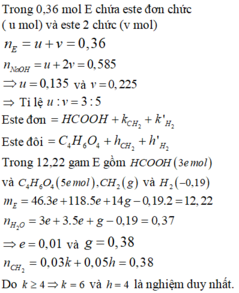

\(\%_{O}=100\%-50,65\%-16,1\%=33,25\%\)
Trong 1 mol hợp chất:
\(\begin{cases} n_{Zn}=\dfrac{385.50,65\%}{65}\approx3(mol)\\ n_{P}=\dfrac{385.16,1\%}{31}\approx2(mol)\\ n_{O}=\dfrac{385.33,25\%}{16}\approx8(mol) \end{cases}\)
Do đó CTHH hợp chất là \(Zn_3(PO_4)_2\)