Khử hoàn toàn 8 gam đồng (II) oxit bằng khí hiđro ở nhiệt độ cao. Hãy tính thể tích khí hiđro (đktc) cần dùng.(Cho Cu = 64; O = 16)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CuO}=\dfrac{8}{80}=0,1mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,1 0,1 ( mol )
\(m_{Cu}=0,1.64=6,4g\)

`CuO+ H_2 -> Cu+ H_2O`
`0,03 ----0,03` mol
`Fe_2O_3+ 3H_2 ->2Fe + 3H_2O`
`0,1-------0,3` mol
`n_(CuO) = 2,4/80 =0,03` mol
`n_(Fe_2O_3)=16/160 =0,1` mol
`=> V_(H_2)=(0,3+0,03).22,4=7,392 l`
có đk nhiệt nha em, p.ứ nay nung nóng mà

`n_[CuO]=[0,8]/80=0,01(mol)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,01` `0,01` `0,01` `(mol)`
`a)m_[Cu]=0,01.64=0,64(g)`
`b)V_[H_2]=0,01.22,4=0,224(l)`
`c)`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,01` `0,02` `0,01` `(mol)`
`@m_[Fe]=0,01.56=0,56(g)`
`@m_[dd HCl]=[0,02.36,5]/20 . 100=3,65(g)`

nCuO = 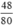 = 0,6 mol.
= 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.

1.\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
2.\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,2 ( mol )
0,15 0,15 ( mol )
\(m_{Cu}=0,15.64=9,6g\)
\(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{8}{80}=0,1\left(mol\right)\)
PTHH: \(CuO+H_2\rightarrow Cu+H_2O\)
.............1.............1...............................
.............0,1...........0,1...........................
\(V_{H_2\left(ĐKTC\right)}=n_{H_2}\cdot22,4=0,1\cdot22,4=2,24\left(l\right)\)
nCuO=8/80=0,1(mol)
CuO+H2->Cu+H2O
1 : 1 : 1 : 1 (mol)
0,1: 0,1 : 0,1: 0,1 (mol)
VH2=0,1x22,4=2,24(lít)