a. Al2O3 + H2SO4 --- Al2(SO4)3 + H2O b. Fe(OH)3 + HCl → FeCl3 + H2O e. Ca(OH)2 + FeCl3 → Fe(OH)3 + CaCl2
sos các bạn ơi
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. \(C\%_{NaCl}=\dfrac{10}{10+190}.100\%=5\%\)
2. \(n_{NaOH}=\dfrac{4}{40}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{NaOH}}=\dfrac{0,1}{0,4}=0,25\left(M\right)\)
3. \(n_{H_2}=\dfrac{7,437}{24,79}=0,3\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
____0,3______0,6______0,3___0,3 (mol)
a, \(m_{Mg}=0,3.24=7,2\left(g\right)\)
b, \(C_{M_{HCl}}=\dfrac{0,6}{0,2}=3\left(M\right)\)
c, \(m_{MgCl_2}=0,3.95=28,5\left(g\right)\)

Tìm một số,biết rằng lấy nó nhân với 0,25 rồi cộng với 75 thì cũng bằng kết quả khi lấy nó chia cho 0,25 rồi trừ đi 75

Lượng nước cần cung cấp cho Hà Nội mỗi ngày là: V H 2 O = 8000000 . 200 = 1600000000 ( l ) = 1600000 ( m 3 ) Lượng clo cần xử lý là: m C l 2 ( C a n x u l y ) = 5 . 160000 = 8000000 ( g ) = 8000 k g

1) MgCL2 + 2KOH ==> Mg(OH)2 + 2KCl
2) Cu(OH)2 + 2HCl ==> CuCl2 + 2H2O
3) CuSO4 + H2SO4 ==> CuSO4 + 2H2O
4) FeO + 2HCl ==> FeCL2 + H2O
5) Fe2O3 + 3H2SO4 ==> Fe2(SO4)3 + 3H2O
6) Cu(NO3)2 + 2NaOH ==> Cu(OH)2 + 2NaNO3
7) 4P + 5O2 ==> 2P2O5
8) N2 + O2 ==> 2NO
9) 2NO + O2 ==> 2NO2
10) 4NO2 + 3O2 + 2H2O ==> 4HNO3

`#1194`
Qtr sx thép:
- Nguyên liệu: gang, sắt, thép phế liệu, khí oxygen
- Cách thực hiện:
+ Khí oxy được thổi từ dưới lò lên để đốt cháy tạp chất trong gang
+ Các oxide tạo thành ở dạng khí \(\left(\text{CO}_2;\text{ }\text{ SO}_2;...\right)\) sẽ thoát ra theo khí thải, các oxide dạng rắn \(\left(\text{SiO}_2;\text{ MnO}_2;...\right)\) sẽ tạo ra xỉ nhẹ, nổi lên trên thép nóng.
- Xỉ được tách ra để thu lấy thép.
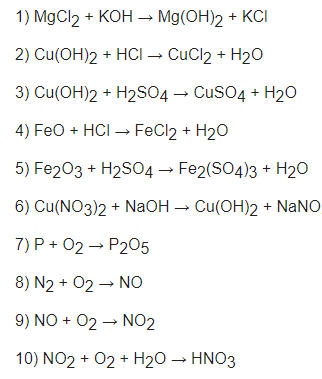


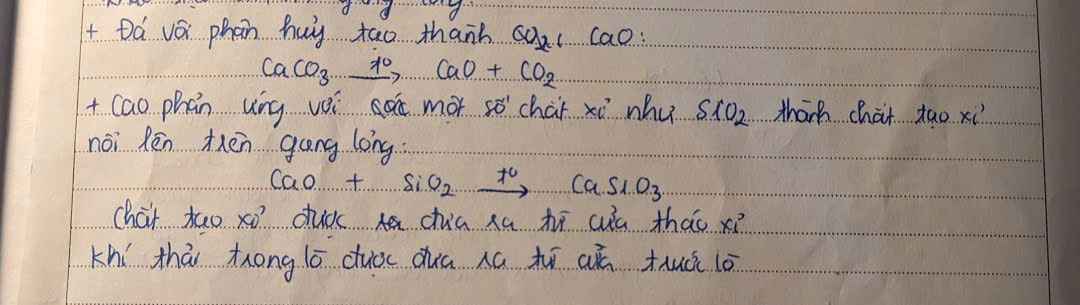
a, \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
b, \(Fe\left(OH\right)_3+3HCl\rightarrow FeCl_3+3H_2O\)
c, \(3Ca\left(OH\right)_2+2FeCl_3\rightarrow2Fe\left(OH\right)_3+3CaCl_2\)