Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mình đã trả lời câu này rồi bạn nhé.
https://hoc24.vn/cau-hoi/hoa-tan-hoan-toan-hon-hop-ba-va-na-vao-nuoc-thu-duoc-dd-x-va-1344-lit-khi-h2dktc-hoi-phai-dung-bao-nhieu-ml-dd-hcl-1m-de-trung-hoa-hoan-toan-dd-x.8547978147909
PT:
Ta có:
Theo PT:
⇒ nHCl = 0,06.2 = 0,12 (mol)
Ý bn là cái này á

Dưới đây là một số dụng cụ thí nghiệm và thiết bị điện cơ bản trong môn Khoa học tự nhiên lớp 8:
Dụng cụ thí nghiệm:
- Ống nghiệm: Dùng để đựng các chất lỏng và thực hiện các thí nghiệm nhỏ.
- Bình đựng nước: Dùng để đo và đựng nước hoặc các dung dịch khác.
- Cốc mứt: Dùng để đựng các dung dịch nhỏ và thực hiện các thí nghiệm nhỏ.
- Cân điện tử: Dùng để đo khối lượng các vật thí nghiệm.
- Bút chì: Dùng để viết và vẽ trên giấy.
- Bút dạ quang: Dùng để viết và vẽ trên bảng tương phản cao.
- Máy đo nhiệt độ: Dùng để đo nhiệt độ của các chất thí nghiệm.
- Máy đo áp suất: Dùng để đo áp suất của các chất thí nghiệm.
- Máy đo độ pH: Dùng để đo độ axit hoặc bazơ của các dung dịch.
- Máy đo độ dẫn điện: Dùng để đo độ dẫn điện của các chất thí nghiệm.
Thiết bị điện cơ bản:
- Đèn bóng đốt: Dùng để tạo ánh sáng trong các thí nghiệm.
- Đèn pin: Dùng để cung cấp nguồn điện cho các thiết bị nhỏ.
- Đồng hồ điện tử: Dùng để đo thời gian trong các thí nghiệm.
- Điện trở: Dùng để điều chỉnh dòng điện trong mạch điện.
- Pin: Dùng để cung cấp nguồn điện cho các thiết bị điện tử như đèn pin, đồng hồ, máy tính...
- Dây dẫn điện: Dùng để kết nối các thành phần trong mạch điện.
- Cái cắt bấm: Dùng để mở và đóng mạch điện.
- Máy phát điện: Dùng để tạo ra nguồn điện trong các thí nghiệm.
Đây chỉ là một số dụng cụ thí nghiệm và thiết bị điện cơ bản trong môn Khoa học tự nhiên lớp 8. Còn rất nhiều dụng cụ và thiết bị khác có thể được sử dụng tùy thuộc vào từng thí nghiệm cụ thể.

\(n_{Ba}=\dfrac{41,1}{137}=0,3\left(mol\right)\\ PTHH:Ba+H_2SO_4\rightarrow BaSO_4+H_2\\ n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\\ Vì:\dfrac{0,2}{1}< \dfrac{0,3}{1}\)
=> Ba dư
\(n_{H_2}=n_{H_2SO_4}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.24,79=4,958\left(l\right)\)

Ta có: \(n_{ZnCl_2}=\dfrac{27,2}{136}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{Zn\left(LT\right)}=n_{ZnCl_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Zn\left(LT\right)}=0,2.65=13\left(g\right)\)
Mà: H = 75% \(\Rightarrow m_{Zn\left(TT\right)}=\dfrac{13}{75\%}=\dfrac{52}{3}\left(g\right)\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\Rightarrow V_{Cl_2}=0,3.24,79=7,437\left(l\right)\)
\(n_{FeCl_3}=n_{Fe}=0,2\left(mol\right)\Rightarrow m_{FeCl_3}=0,2.162,5=32,5\left(g\right)\)

a, Ta có: P + N + E = 34
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 34 (1)
Theo đề, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=11=Z\\N=12\end{matrix}\right.\) ⇒ A = 11 + 12 = 23
→ KH: \(^{23}_{11}X\)
b, Cấu hình e: 1s22s22p63s1
Cấu hình e theo orbital:
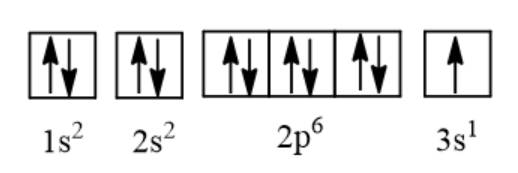
c, X có 1 e hóa trị → tính kim loại
d, - Z = 11 → ô số 11
- Có 3 lớp e → chu kỳ 3
- e cuối cùng phân bố ở phân lớp s, có 1 e hóa trị → nhóm IA
Vậy: X thuộc ô số 11, chu kỳ 3, nhóm IA

a, \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
b, \(n_{HCl}=0,2.0,5=0,1\left(mol\right)\)
Theo PT: \(n_{CuO}=n_{CuCl_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\)
\(\Rightarrow m_{CuO}=0,05.80=4\left(g\right)\)
c, \(C_{M_{CuCl_2}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
\(n_{HCl}=0,2.0,5=0,1\left(mol\right)\)
PTHH :
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
0,05 0,1 0,05
\(b,m_{CuO}=0,05.80=4\left(g\right)\)
\(c,C_{M\left(CuCl_2\right)}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
Ta có: \(n_{H_2}=0,04\left(mol\right)\Rightarrow n_Y=0,08\left(mol\right)\)
Mà: mY - mH2 = 2,48 ⇒ mY = 2,56 (g)
\(\Rightarrow M_Y=\dfrac{2,56}{0,08}=32\left(g/mol\right)\)
→ Y là CH3OH.
\(\Rightarrow n_X=n_Y=0,08\left(mol\right)\)
Ta có: \(n_{H_2O}=\dfrac{3,96}{18}=0,22\left(mol\right)\)
mX = mC + mH + mO ⇒ mC = 5,88 - 0,22.2 - 0,08.2.16 = 2,88 (g)
\(\Rightarrow n_{CO_2}=n_C=\dfrac{2,88}{12}=0,24\left(mol\right)\)
⇒ n este không no = 0,24 - 0,22 = 0,02 (mol)
⇒ n este no = 0,06 (mol)
Gọi: CTPT của este không no là CnH2n-2O2 (n ≥ 5) và este no là CmH2mO2 (m > 2)
BTNT C, có: 0,02n + 0,06m = 0,24
⇒ n + 3m = 12
Với n = 5, m = 7/3 là thỏa mãn.
→ C5H8O2: 0,02 (mol)
\(\Rightarrow\%m_{C_5H_8O_2}=\dfrac{0,02.100}{5,88}.100\%\approx34,01\%\)