Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+ Hòa tan 3 chất rắn vào nước được 3 dung dịch
+ Nhúng mẩu giấy quỳ tím vào 3 dung dịch
- Dung dịch làm quỳ tím chuyển sang màu đỏ là dung dịch hòa tan từ P2O5
- Dung dịch làm quỳ tím chuyển sang màu xanh là dung dịch hòa tan từ Na2O
- Dung dịch không làm quỳ tím đổi màu là dung dịch hòa tan từ NaCl

500ml=0.5l
nBaOH2 =0.5 x1=0.5 mol
MH2SO4=500.15%=75g
nH2SO4= xấp xỉ 0.8mol
H2SO4 dư tính theo BaOH2
pthh: Ba(OH)2 + H2SO4 => BaSO4+H2O
Theo pthh nBaSO4= nBa(OH)2=0.5mol
=>m kết tủa= 0.5x233=116.5g
theo pthh nH2SO4 phản ứng=nBaOH2= 0.5 mol
=> nH2SO4 Dư=0.8-0.5=0.3 mol
=>
m dư=0.3x98=29.4g
mH2SO4 đã dùng là m phản ứng? nếu thế thì m đã dung là 75-29.4=45.6
còn nếu m đã dùng là m chất tan thi là 75g như trên =))

`Mg + H_2SO_4 -> MgSO_4 + H_2`
`Fe + H_2SO_4 -> FeSO_4 + H_2`
`2Al + 3H_2SO_4 -> Al_2(SO_4)_3 + 3H_2`
`H_2SO_4 + 2KOH -> K_2SO_4 + 2H_2O`
`MgSO_4 + 2KOH -> Mg(OH)_2 + K_2SO_4`
`FeSO_4 + 2KOH -> Fe(OH)_2 + K_2SO_4`
`Al_2(SO_4)_3 + 6KOH -> 2Al(OH)_3 + 3K_2SO_4`
`Al(OH)_3 + KOH -> KAlO_2 + 2H_2O`
$Mg(OH)_2 \xrightarrow{t^o} MgO + H_2O$
$4Fe(OH)_2 + O_2 \xrightarrrow{t^o} 2Fe_2O_3 + 4H_2O$
$2Cu + O_2 \xrightarrow{t^o} 2CuO$
Ta có: \(M_X=32.2=64\left(g/mol\right)\Rightarrow X:SO_2\)
`Mg(OH)_2 + H_2SO_4 -> MgSO_4 + 2H_2O`
`2Fe(OH)_2 + 4H_2SO_{4(đ,n)} -> Fe_2(SO_4)_3 + SO_2 + 6H_2O`
`Cu + 2H_2SO_{4(đ,n)} -> CuSO_4 + SO_2 + 2H_2O`
`CO_2 + KOH -> KHCO_3`
`CO_2 + KAlO_2 + 2H_2O -> Al(OH)_3 + KHCO_3`

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
$m_{FeO} = 18,4 - 11,2 = 7,2(gam)$
b) $n_{FeO} = 0,1(mol)$
Theo PTHH : $n_{H_2SO_4} = n_{Fe} + n_{FeO} = 0,3(mol)$
$m_{dd\ H_2SO_4} = \dfrac{0,3.98}{7\%} = 420(gam)$
c) $m_{dd\ sau\ pư} = 18,4 + 420 - 0,2.2 = 438(gam)$
$n_{FeSO_4} = n_{Fe} + n_{FeO} = 0,3(mol)$
$C\%_{FeSO_4} = \dfrac{0,3.152}{438}.100\% =10,4\%$
nH2=4,48/22,4=0,2(mol)
=>nFe=0,2(mol)=>mFe=0,2.56=11,2(g)
=>mFeO=18,4-11,2=7,2(g)
b)nH2SO4=nH2=0,2(mol)
=>mH2SO4 7%=0,2.98=19,6(g)
=>mH2SO4 =19,6:7%=280(g)
c)mFeSO4=0,2.152=30,4(g)
mdd sau pư=18,4+280-0,2.2=298(g)
=>C%FeSO4==10,2%

a) $n_{K_2O} = \dfrac{9,4}{94} = 0,1(mol)$
$K_2O + H_2O \to 2KOH$
$n_{KOH} = 2n_{K_2O} = 0,2(mol)$
$C_{M_{KOH}} = \dfrac{0,2}{0,2} = 1M$
b)
$2KOH + H_2SO_4 \to K_2SO_4 + 2H_2O$
Ta thấy :
$n_{KOH} : 2 < n_{H_2SO_4} : 1$ nên $H_2SO_4$ dư
$n_{K_2SO_4} = n_{H_2SO_4\ pư} = \dfrac{1}{2}n_{KOH} = 0,1(mol)$
$n_{H_2SO_4\ dư} = 0,2 - 0,1 = 0,1(mol)$
$m_{dd KOH} = 1,14.200 = 228(gam) ; m_{dd\ H_2SO_4} = 1,12.200 = 224(gam)$
$m_{dd\ sau\ pư} = 228 + 224 = 452(gam)$
$C\%_{K_2SO_4} = \dfrac{0,1.174}{452}.100\% = 3,84\%$
$C\%_{H_2SO_4\ dư} = \dfrac{0,1.98}{452}.100\% = 2,17\%$

Phân tích: Chất tham gia phản ứng có 1 muối, chất sản phẩm có 1 bazơ. Như vậy ta sẽ liên tưởng đến phản ứng:
muối + bazơ \(\rightarrow\) muối mới + bazơ mới
Ta sẽ có phương trình hóa học sau: \(CaCO_3+2KOH\rightarrow K_2CO_3+Ca\left(OH\right)_2\)

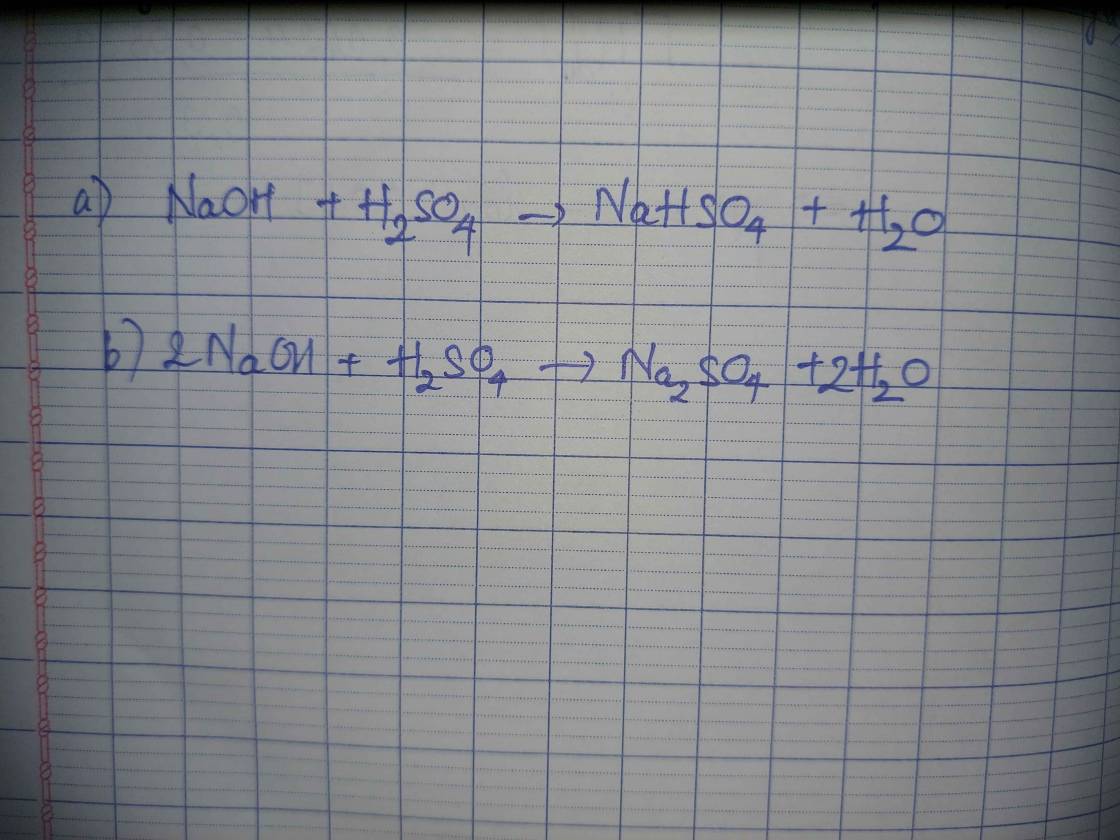

a) Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\n_{AgNO_3}=0,2.0,1=0,02\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=0,2.0,5=0,1\left(mol\right)\end{matrix}\right.\)
PTHH: \(Fe+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2Ag\downarrow\) (1)
ban đầu 0,4 0,02
sau pư 0,39 0 0,01 0,02
\(Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\downarrow\) (2)
ban đầu 0,39 0,1
sau pư 0,29 0 0,1 0,1
=> mA = 0,1.64 + 0,02.108 + 0,29.56 = 24,8 (g)
b) \(C_{M\left(Fe\left(NO_3\right)_2\right)}=\dfrac{0,1+0,01}{0,2}=0,55M\)