Hòa tan hoàn toàn 12g hỗn hợp (gồm Fe và Cu có tỉ lệ mol là 1:1) bằng axit HNO3, thu được V lít hỗn hợp khí X (gồm NO và NO2) và dung dịch Y. Tỉ khối của X với H2 là 19. Tính V (biết các khí đo ở điều kiện tiêu chuẩn)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b, \(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(n_{C_2H_4}=n_{Br_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,1.22,4}{3,36}.100\%\approx66,67\%\\\%V_{CH_4}\approx33,33\%\end{matrix}\right.\)

a, - Trích mẫu thử.
- Dẫn từng mẫu thử qua Ca(OH)2 dư.
+ Xuất hiện kết tủa trắng: CO2
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
+ Không hiện tượng: CH4, C2H2. (1)
- Dẫn mẫu thử nhóm (1) qua dd Br2.
+ Dd Br2 nhạt màu: C2H2.
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
+ Không hiện tượng: CH4.
- Dán nhãn.
b, - Trích mẫu thử.
- Dẫn từng mẫu thử qua dd AgNO3/NH3 dư.
+ Xuất hiện tủa vàng: C2H2.
PT: \(C_2H_2+2AgNO_3+2NH_3\rightarrow Ag_2C_{2\downarrow}+2NH_4NH_3\)
+ Không hiện tượng: CH4, C2H4. (1)
- Dẫn mẫu thử nhóm (1) qua bình đựng dd Br2.
+ Dd Br2 nhạt màu: C2H4.
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
+ Không hiện tượng: CH4.
- Dán nhãn.

\(\Delta_rH^0_{298}=-542,83-167,16-\left(-795,0\right)=85,01\left(kJ\right)\)
\(\Delta_fH^0_{298}=-542,83-2.167,16-\left(-795,0\right)\) \(=-82,15\left(kJ\right)\)

Chất oxi hóa : HNO3
Chất khử : Fe
Quá trình oxi hóa : Fe ---> Fe+3 + 3e x 1
Quá trình khử N+5 + 3e ---> N+2 x 1
Fe + 4HNO3 ----> Fe(NO3)3 + NO + 2H2O

a, - Trích mẫu thử.
- Dẫn từng mẫu thử qua CuO (đen) nung nóng.
+ Chất rắn từ đen chuyển đỏ: H2.
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
+ Không hiện tượng: O2, không khí. (1)
- Cho que đóm đang cháy vào mẫu thử nhóm (1)
+ Que đóm tiếp tục cháy: O2.
+ Que đóm cháy 1 lúc rồi tắt: không khí.
- Dán nhãn.
b, - Trích mẫu thử.
- Dẫn từng mẫu thử qua Ca(OH)2 dư.
+ Xuất hiện kết tủa trắng: CO2.
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
+ Không hiện tượng: H2, O2. (1)
- Dẫn mẫu thử nhóm (1) qua CuO (đen) nung nóng.
+ Chất rắn từ đen chuyển đỏ: H2.
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
+ Không hiện tượng: O2.
- Dán nhãn.

a, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right)\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,025\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,025.22,4}{5,6}.100\%=10\%\\\%V_{CH_4}=90\%\end{matrix}\right.\)
b, Ta có: \(n_{CH_4}=\dfrac{5,6.90\%}{22,4}=0,225\left(mol\right)\)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_4}=0,275\left(mol\right)\)
\(n_{H_2O}=2n_{CH_4}+2n_{C_2H_4}=0,5\left(mol\right)\)
⇒ m sản phẩm = mCO2 + mH2O = 0,275.44 + 0,5.18 = 21,1 (g)
c, PT: \(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{3}n_{CO_2}=\dfrac{11}{120}\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=\dfrac{11}{120}.160=\dfrac{44}{3}\left(g\right)\)
nX = 5,622,4=0,25
0,25 (mol) nBr2 = 4160=0,025
0,025 (mol)
nX = nCH4 + nC2H2
C2H2 + 2Br2 --> C2H2Br4
0,05 <-- 0,025
=> nCH4 = 0,25 - 0,05 = 0,2 (mol)
a. => %VCH4 = 0,20,25.100%=80%0,250,2.100%=80%
=> %VC2H2 = 100% - 80% = 20%
b. Đốt cháy khí X
CH4 + O2 --> CO2 + 2H2O
0,2 0,2 0,4
2C2H2 + 3O2 ---> 4CO2 + 2H2O
0,05 0,1 0,05
nCO2 = 0,2 + 0,1 = 0,3 (mol) => mCO2 = 0,3 .44 = 13,2 (g)
nH2O = 0,4 + 0,05 = 0,45 (mol) => mH2O = 0,45 . 18 = 8,1 (g)
=> m = mCO2 + mH2O = 13,2 + 8,1 = 21,3 (g)
c. nCO2 = 0,3 (mol)
Fe2O3 + 3CO --> 2Fe + 3CO2
0,1 <-- 0,3
nFe2O3 = 0,1 (mol)
=> mFe2O3 = 0,1 . 160 = 16(g)

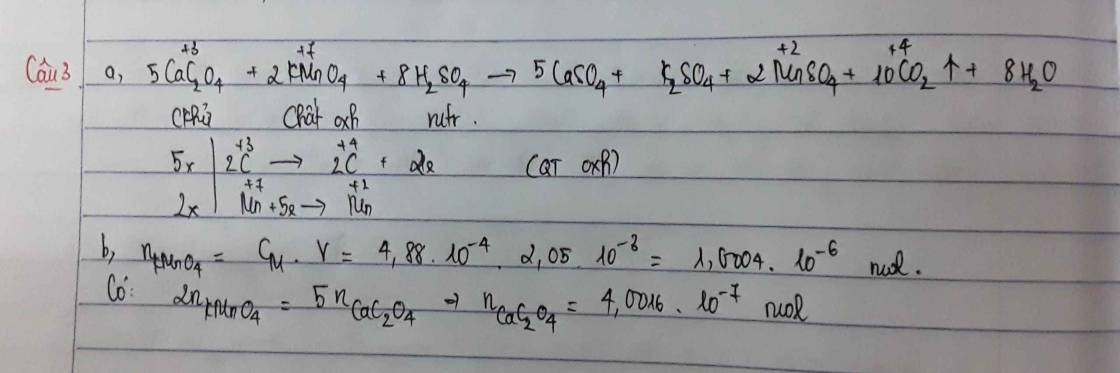
Gọi: nFe = nCu = x (mol)
⇒ 56x + 64x = 12 ⇒ x = 0,1 (mol)
Gọi: \(\left\{{}\begin{matrix}n_{NO}=a\left(mol\right)\\n_{NO_2}=b\left(mol\right)\end{matrix}\right.\)
BT e, có: 3nFe + 2nCu = 3nNO + nNO2
⇒ 3a + 2b = 0,5 (1)
Mà: Tỉ khối của X với H2 là 19.
\(\Rightarrow\dfrac{30a+46b}{a+b}=19.2\left(2\right)\)
Từ (1) và (2) ⇒ a = b = 0,1 (mol)
\(\Rightarrow V_{hh}=\left(0,1+0,1\right).22,4=4,48\left(l\right)\)