Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bài1
ta có dA/H2=22 →MA=22MH2=22 \(\times\) 2 =44
nA=\(\frac{5,6}{22,4}\)=0,25
\(\Rightarrow\)mA=M\(\times\)n=11 g
MA=dA/\(H_2\)×M\(H_2\)=22×(1×2)=44g/mol
nA=VA÷22,4=5,6÷22,4=0,25mol
mA=nA×MA=0,25×44=11g

Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%
B. 68,8%
C. 76%
D. 62,5%
Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
A. Fe3O4.
B. FeO.
C. Fe3O2.
D. Fe2O3.
Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?
A. 71,0 gam.
B. 35,5 gam.
C. 142,0 gam
D. 106,5 gam.
Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?
A. 2 mol.
B. 4 mol.
C. 5 mol.
D. 3 mol.
Câu 5: Khối lượng của Fe trong 92,8 g Fe3O4 là
A. 25,6 g.
B. 67,2 g.
C. 80 g.
D. 10 g.

a) %Cl = 60,68%
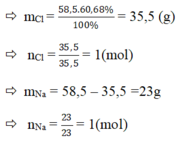
Vậy trong 1 phân tử hợp chất A có : 1 nguyên tử Na, 1 nguyên tử Cl.
⇒ CTHH của hợp chất A : NaCl
b)
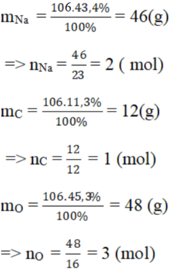
Vậy trong 1 phân tử hợp chất B có: 2 nguyên tử Na, 1 nguyên tử C, 3 nguyên tử O.
⇒ CTHH của hợp chất B : Na2CO3.

Trong 1 mol hợp chất:
$n_H=\dfrac{98.2,04\%}{1}\approx 2(mol)$
$n_S=\dfrac{98.32,65\%}{32}\approx 1(mol)$
$n_O=\dfrac{98-2-32}{16}=4(mol)$
$\to CTHH:H_2SO_4$

Đặt CTTQ : FexOy (x,y: nguyên, dương)
mFe=70%.160=112(g) -> x= 112/56=2
mO=160-112=48(g) -> y=48/16=3
=> Với x=2; y=3 => CTHH oxit sắt cần tìm Fe2O3
Chúc em học tốt!

\(m_C=\dfrac{342.42,11\%}{100\%}=144\left(g\right)\)
\(n_C=\dfrac{144}{12}=12\left(mol\right)\)
\(m_O=\dfrac{342.51,46\%}{100\%}=176\left(g\right)\)
\(n_O=\dfrac{176}{16}=11\left(mol\right)\)
\(m_H=342-144-176=22\left(g\right)\)
\(n_H=\dfrac{22}{1}=22\left(mol\right)\)
\(=>CTHH:C_{12}H_{22}O_{11}\)
=> Chọn B
Gọi CTHH của X là: \(\left(C_xH_yO_z\right)_n\)
Ta có: \(x:y:z=\dfrac{42,11\%}{12}:\dfrac{100\%-51,46\%-42,11\%}{1}:\dfrac{51,46\%}{16}=3,5:6,43:3,2\approx1:2:1\)
Vậy CTHH của X là: \(\left(CH_2O\right)_n\)
Theo đề, ta có: \(M_X=\left(12+1.2+16\right).n=342\left(g\right)\)
\(\Leftrightarrow n=11,4\)
Hình như khối lượng mol sai thì phải

\(m_{Fe}=180.31,11\%=56\left(g\right)\\ m_N=180.15,56\%=28\left(g\right)\\ m_O=180-56-28=96\left(g\right)\)
\(n_{Fe}=\dfrac{56}{56}=1\left(mol\right)\\ n_N=\dfrac{28}{14}=2\left(mol\right)\\ n_O=\dfrac{96}{16}=6\left(mol\right)\)
\(CTHH:Fe\left(NO_3\right)_2\)
(đề lỗi nên mik sửa Bari thành Sắt nhé chứ Bari nặng tới 137 g/mol)
Dưới đây là hướng dẫn xác định công thức các hợp chất theo từng câu hỏi bạn đưa ra. Phương pháp chung là dựa vào phần trăm khối lượng các nguyên tố, tính số mol tương đối rồi tìm tỉ lệ nguyên tử trong phân tử.
a) Hợp chất Mg và O, phân tử khối = 40, % khối lượng Mg = 60%, O = 40%
Tính số mol nguyên tử:
Tỉ lệ mol Mg : O = 1 : 1 → công thức phân tử là MgO.
b) Hợp chất S và O, phân tử khối = 64, % O = 50%
Tính số mol nguyên tử:
Tỉ lệ S : O = 1 : 2 → công thức phân tử là SO₂.
c) Hợp chất D gồm Na, S, O; mol phân tử = 126 g; % Na = 36,508%; % S = 25,4%; còn lại là O
Tính số mol nguyên tử:
Tỉ lệ Na : S : O = 2 : 1 : 3 → công thức phân tử là Na₂SO₃.
d) Hợp chất E gồm K, Mn, O; nặng hơn NaNO₃ 1,86 lần
Tính số mol nguyên tử:
Tỉ lệ K : Mn : O = 1 : 1 : 4 → công thức phân tử là KMnO₄.
e) Hợp chất F gồm H và S; % H = 5,88%; nặng hơn H₂ 17 lần
Tính khối lượng nguyên tố trong 1 mol:
Tính số mol nguyên tử:
Tỉ lệ H : S = 2 : 1 → công thức phân tử là H₂S.
f) Hợp chất G gồm H, C, O; % H = 3,7%; % C = 44,44%; % O = 51,86%; khối lượng mol = khối lượng mol của Al (27 g/mol)
Tính số mol nguyên tử:
Tỉ lệ H : C : O ≈ 1 : 1 : 0,875 → nhân cả 4 để loại số thập phân:
Nhưng số nguyên tử phải là số nguyên, nên có thể làm tròn O thành 4 → công thức gần đúng là C₄H₄O₄ hoặc CHO dạng đơn giản hơn.
g) Hợp chất H gồm Mg, C, O; % Mg = 28,57%; % C = 14,285%; % O = 57,145%; khối lượng mol = 84 g/mol
Tính số mol nguyên tử:
Tỉ lệ Mg : C : O = 1 : 1 : 3 → công thức phân tử là MgCO₃.
Nếu bạn cần giải thích chi tiết từng bước hoặc hỗ trợ tính toán, hãy cho mình biết nhé!