Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Lập công thức khi biết hóa trị
Giả sử hợp chất gồm 2 nguyên tố A và B, có hóa trị lần lượt là \(x\) và \(y\).
- Quy tắc: Tích chéo hóa trị → chỉ số nguyên tử.
\(A_{x} B_{y} \rightarrow A_{y} B_{x}\)
📌 Ví dụ: Lập công thức của hợp chất giữa Al (III) và O (II):
\(A l^{3 +} , \&\text{nbsp}; O^{2 -} \Rightarrow A l_{2} O_{3}\)
2. Lập công thức khi biết thành phần phần trăm khối lượng các nguyên tố
Quy trình:
Bước 1: Giả sử có 100 g hợp chất
→ số gam mỗi nguyên tố chính bằng phần trăm của nó.
Bước 2: Tính số mol từng nguyên tố
\(n = \frac{\text{kh} \overset{ˊ}{\hat{\text{o}}} \text{i}\&\text{nbsp};\text{l}ượ\text{ng}}{\text{nguy} \hat{\text{e}} \text{n}\&\text{nbsp};\text{t}ử\&\text{nbsp};\text{kh} \overset{ˊ}{\hat{\text{o}}} \text{i}}\)
Bước 3: Chia số mol cho giá trị nhỏ nhất
→ được tỉ lệ số nguyên tử gần đúng.
Bước 4: Rút gọn thành số nguyên tối giản
→ đó là công thức đơn giản nhất (công thức nguyên).
Bước 5 (nếu đề cho M – khối lượng mol của hợp chất):
Tính hệ số \(k = \frac{M_{t h ự c}}{M_{đo n g i ả n}}\).
Nhân toàn bộ chỉ số trong công thức đơn giản với \(k\) để ra công thức phân tử.
📌 Ví dụ: Hợp chất X có 40% C, 6,7% H, 53,3% O. Xác định công thức.
- Giả sử 100 g chất → C: 40 g, H: 6,7 g, O: 53,3 g.
- Số mol:
\(n_{C} = \frac{40}{12} \approx 3.33 , n_{H} = \frac{6.7}{1} \approx 6.7 , n_{O} = \frac{53.3}{16} \approx 3.33\) - Chia cho số nhỏ nhất (3.33):
\(C : 1 , \&\text{nbsp}; H : 2 , \&\text{nbsp}; O : 1\)
→ Công thức đơn giản nhất: CH₂O.
- Nếu khối lượng mol thực tế cho là 60 g/mol → khối lượng mol CH₂O = 30 → \(k = 2\).
→ Công thức phân tử: C₂H₄O₂.

\(Đặt:Al_a^{III}O_b^{II}\left(a,b:nguyên,dương\right)\\ QT.hoá.trị:a.III=II.b\Rightarrow\dfrac{a}{b}=\dfrac{II}{III}=\dfrac{2}{3}\Rightarrow a=2;b=3\\ CTTQ:Al_2O_3\\ m_{Al_2O_3}=2.27+3.16=102\left(đ.v.C\right)\)

Gọi ct chung: \(Na_xCl_y\)
\(\%Cl=100\%-39,316\%=60,684\%\)
\(K.L.P.T=23.x+35,5.y=58,5< amu>.\)
\(\%Na=\dfrac{23.x.100}{58,5}=39,316\%\)
\(Na=23.x.100=39,316.58,5\)
\(Na=23.x.100=2299,986\)
\(23.x=2299,986\div100\)
\(23.x=22,99986\)
\(x=22,99986\div23=0,999....\) làm tròn lên là 1.
vậy, có 1 nguyên tố Na trong phân tử \(Na_xCl_y.\)
\(\%Cl=\dfrac{35,5.y.100}{58,5}=60,684\%\)
\(\Rightarrow y=1,00...\) làm tròn lên là 1 (cách giải như phần trên).
vậy cthh của A: \(NaCl.\)

`@` `\text {dnammv}`
`1,`
`a,` Gọi ct chung: \(\text{C}^{\text{IV}}_x\text{O}^{\text{II}}_{\text{y}}\)
Theo qui tắc hóa trị: \(\text{IV}\cdot\text{x}=\text{II}\cdot\text{y}\rightarrow\dfrac{\text{x}}{\text{y}}=\dfrac{\text{II}}{\text{IV}}=\dfrac{1}{2}\)
`-> \text {x=1, y=2}`
`-> \text {CTHH: CO}_2`
\(\text{PTK}_{\text{CO}_2}=12+16\cdot2=44\text{ }< \text{amu}>\)
`b,`
Gọi ct chung: \(\text{Na}^{\text{I}}_{\text{x}}\left(\text{SO}_4\right)^{\text{II}}_{\text{y}}\)
Theo qui tắc hóa trị: \(\text{I}\cdot\text{x}=\text{II}\cdot\text{y}\rightarrow\dfrac{\text{x}}{\text{y}}=\text{ }\dfrac{\text{II}}{\text{I}}\)
`-> \text {x=2, y=1}`
`-> \text {CTHH: Na}_2 \text {SO}_4`

Đặt CT kèm hoá trị là : \(Ba^a\left(SO_4\right)^{II}\) (a: hoá trị của Ba)
Theo QT hoá trị ta có: a.1= II.1
=> a= (II.1)/1= II
Vậy: Ba có hoá trị (II) trong CTHH BaSO4
Đặt CT kèm hoá trị là : \(Cu^b\left(OH\right)^I_2\) (b: hoá trị của Ba)
Theo QT hoá trị ta có: b.1= I.2
=> b= (I.2)/1= II
Vậy: Cu có hoá trị (II) trong CTHH Cu(OH)2

Khi biết được hóa trị của các nguyên tố trong hợp chất ta có thể xác định được công thức hóa học của hợp chất.
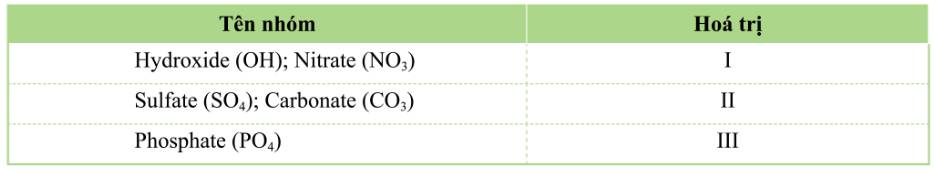
(hóa trị 1) với O; b) của Cu (hóa trị 2) với O; c) Tính khối lượng các nguyên tố hóa học trong đạm ure NH₂CONH₂
a) Na (I) với O (II):
b) Cu (II) với O (II):
c) Khối lượng các nguyên tố trong NH₂CONH₂ (ure):