Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. nH2 = nFe = 0,1mol
Bảo toàn nguyên tố Fe => nFe2O3 = 0,05mol
=> mFe2O3 = 8g
=> %Fe2O3 = (8:10) . 100% = 80%

1
nMnO2= 8,7/87 = 0,1 mol
MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
0,1 ------------------------------- 0,1 (mol)
V Cl2 = 0,1 x 22,4 = 2,24 lít
H%=1,9/2,24x100%= 85%
2
pt:
Fe2O3+3CO---t*--->2Fe+3CO2
mFe2O3 p/ứ=32.80%=25,6(g)
=>nFe2O3=25,6/160=0,16(mol)
Theo pt: nFe=2nFe2O3=2.0,16=0,32(mol)
=>mFe=0,32.56=17,92(g)
3
a) Gọi CTHH của oxit sắt là: FexOy
PTHH: : FexOy + yCO ------> xFe + yCO2
Số mol Fe là

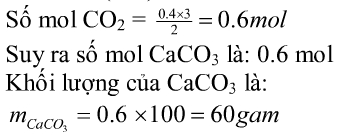

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
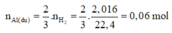
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
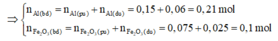
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

A, Gọi X,y lần lượt là số mol của Mg và Al
Pthh:
Mg + H2SO4---> MgSO4 + H2
X. X. X. X
2Al + 3H2SO4---> Al2(SO4)3+3H2
Y. 1.5y. Y. 1.5y
Ta có pt:
24x + 27y= 1.95
X+1.5y=2.24/22.4=0.1
=> X=0.025, Y=0.05
%Mg= 0.025×24×100)/1.95=30.8%
%Al= 100%-30.8%=69.2%
mH2SO4= 0.025+1.5×0.05=0.1g
mH2= (0.025+0.05)×2=0.15g
C, Mdd H2SO4 = 0.1/6.5×100=1.54g
MddY= 1.54+1.95-0.15=3.34g
%MgSO4 vs %Al2(SO4)3 b tự tính nha

Câu 1:
Ta có: 1 tấn = 1000 kg
⇒ mFe = 1000.95% = 950 (kg)
\(\Rightarrow n_{Fe}=\dfrac{950}{56}\left(kmol\right)\)
BTNT Fe, có: \(n_{Fe_2O_3\left(LT\right)}=\dfrac{1}{2}n_{Fe}=\dfrac{475}{56}\left(kmol\right)\)
Mà: H = 80% \(\Rightarrow n_{Fe_2O_3\left(TT\right)}=\dfrac{475}{56}:80\%=\dfrac{2375}{224}\left(kmol\right)\)
\(\Rightarrow m_{Fe_2O_3\left(TT\right)}=\dfrac{2375}{224}.160=\dfrac{11875}{7}\left(kg\right)\)
⇒ m quặng \(=\dfrac{m_{Fe_2O_3}}{60\%}\approx2827,38\left(kg\right)\)
Câu 2:
Ta có: 65nZn + 27nAl = 3,79 (1)
PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,05\left(mol\right)\\n_{Al}=0,02\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=0,05.65=3,25\left(g\right)\\m_{Al}=0,02.27=0,54\left(g\right)\end{matrix}\right.\)

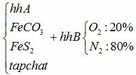
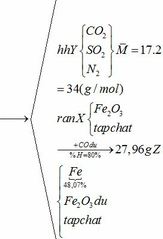
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
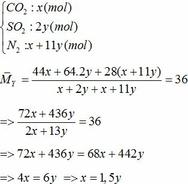
Khối lượng Fe có trong Z là:
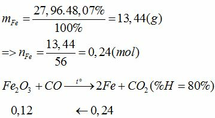
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
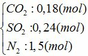
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
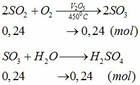
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
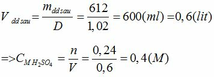

phương trình phản ứng
FeO + H2 = Fe + H2O (1)
y y mol
Fe2O3 + 3H2 = 2Fe + 3H2O (2)
z 2z mol
Fe + CuSO4(dung dịch pha loãng) = FeSO4 + Cu↓ (3)
x x mol
theo phương trình phản ứng (3) áp dụng định luật thay đổi khối lhuowngj ta có 64x - 56x = 4,96 - 4,72 => x=0,03 mol
khối lượng của Fe là mFe = 0,03.56=1,68(g)
khối lượng của oxit sắt còn lại là 3,04 g
theo bài ra ta có phương trình
72y + 160z = 3,04
56y + 56.2z = 3,92 - 1,68
giải hệ phương trình ta có y= 0,02 z= 0,01
còn lại khối lượng bạn tự tính nha![]()

TN1 Fe ---> Fe
x x mol
FeO+ H2 ---> Fe + H2O
y y
Fe2O3 + 3H2---> 2Fe + 3H2O
z 2z
=> 56x + 72y+ 160z=2,36
TN2 Fe + CuSO4---> FeSO4+ Cu
x x mol
FeO và Fe2O3 không tác dụng
=> 64x+ 72y+ 16O z=2,48
lại có 56x+ 72y+ 160z=2,36
giả hệ 3 pt => x=0,015 ,y= 0,01 , z=0,005
=> mFe=0,84 gan , mFeO=0,72 gam, mFe2O3=0,8 gam.
Ta có: \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe\left(LT\right)}=2n_{Fe_2O_3}=0,4\left(mol\right)\)
Mà: H = 80% ⇒ nFe (TT) = 0,4.80% = 0,32 (mol)
⇒ mFe (TT) = 0,32.56 = 17,92 (g)
Nó đề cập đến phản ứng hóa học giữa khí hydro (H2) đi qua oxit sắt(III) (Fe2O3) để tạo ra sắt và nước, với hiệu suất là 80%.