Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
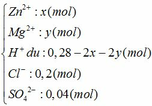
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
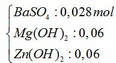
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

\(n_{Na_2CO_3}=0,1.1=0,1\left(mol\right)\)
a. \(Na_2CO_3+Ba\left(OH\right)_2\rightarrow BaCO_3+2NaOH\)
0,1 0,1 0,1 0,2
b. \(m_{kt}=m_{BaCO_3}=0,1.197=19,7\left(g\right)\)
c. \(C\%_{Ba\left(OH\right)_2}=\dfrac{0,1.171.100}{200}=8,55\%\)
d. \(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\)
0,1 0,2
=> \(a=m_{dd.HCl}=\dfrac{0,2.36,5.100}{30}=\dfrac{73}{3}\left(g\right)\)

Gọi $n_{Na_2CO_3\ pư} = 0,1a(mol) ; n_{NaHCO_3\ pư} = 0,3a(mol)$
$Na_2CO_3 + H_2SO_4 \to Na_2SO_4 + CO_2 + H_2O$
$2NaHCO_3 + H_2SO_4 \to Na_2SO_4 + 2CO_2 + 2H_2O$
Theo PTHH :
$n_{H_2SO_4} = 0,1a + 0,3a.0,5 = 0,15 \Rightarrow a = 0,6$
$n_{CO_2} = 0,1a + 0,3a = 0,24(mol)$
Bảo toàn C :
$n_{BaCO_3} = 0,1 + 0,3 - 0,24 = 0,16(mol)$
Bảo toàn S :
$n_{BaSO_4} = n_{H_2SO_4} = 0,15(mol)$
Suy ra :
$m_{ktua} = 0,16.197 + 0,15.233 = 66,47(gam)$

a) \(n_{Ca\left(OH\right)_2}=0,4\left(mol\right);n_{HCl}=0,1\left(mol\right)\)
\(Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\)
0,4................0,1
Lập tỉ lệ : \(\dfrac{0,4}{1}< \dfrac{0,1}{2}\) => Ca(OH)2 dư sau phản ứng
\(n_{CaCl_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\)
=> \(m_{CaCl_2}=0,05.111=5,55\left(g\right)\)
b) Dung dịch thu được sau phản ứng CaCl2 và Ca(OH)2 dư
\(n_{Ca\left(OH\right)_2}=0,4-0,05=0,35\left(mol\right)\)
\(CM_{CaCl_2}=\dfrac{0,05}{0,4+0,1}=0,1M\)
\(CM_{Ca\left(OH\right)_2}=\dfrac{0,35}{0,4+0,1}=0,7M\)
400ml = 0,4l
100ml = 0,1l
Số mol của dung dịch canxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,4=0,4\left(mol\right)\)
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,1=0,1\left(mol\right)\)
Pt : Ca(OH)2 + 2HCl → CaCl2 + 2H2O\(|\)
1 2 1 2
0,4 0,1 0,05
a) Lập tỉ số so sánh : \(\dfrac{0,4}{1}>\dfrac{0,1}{2}\)
⇒ Ca(OH)2 dư , HCl phản ứng hết
⇒ Tính toán dựa vào số mol của HCl
Số mol của muối canxi clorua
nCaCl2 = \(\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
Khối lượng của muối canxi clorua
mCaCl2= nCaCl2 . MCaCl2
= 0,05 . 111
= 5,55 (g)
b) Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng= 0,4 + 0,1 = 0,5 (l)
Nồng độ mol của canxi clorua
CMCaCl2 = \(\dfrac{n}{V}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
Chúc bạn học tốt

a) Đặt nK = a và nAl = b ta có:
39a + 27b = 10,5 (1)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
a............................a
\(Al+KOH+H_2O\rightarrow KAlO_2+\dfrac{3}{2}H_2\)
b...........b...............................b
Thêm từ từ HCl vào dd A lúc đầu không có kết tủa do HCl trung hòa KOH dư:
\(HCl+KOH\rightarrow KCl+H_2O\)
(a-b)<-----(a-b)
Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 + KCl
Để trung hòa hết KOH cần: 0,1. 1 = 0,1 mol HCl
a – b = nHCl = 0,1 (2)
Giải hệ (1) và (2) ta có: a = 0,2 và b = 0,1
=> \(\%m_K=\dfrac{0,2.39}{10,5}=74,29\%\); \(\%m_{Al}=25,71\%\)
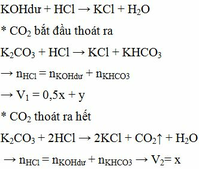
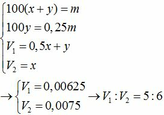

\(n_{HCl}=0,4.1=0,4\left(mol\right)\)
\(n_{H_2SO_4}=0,4.0,5=0,2\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,1.1=0,1\left(mol\right)\)
Vì \(\dfrac{n_{H_2SO_4}}{n_{Ba\left(OH\right)_2}}=\dfrac{0,2}{0,1}=2>1\) \(\Rightarrow H_2SO_4\) dư
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
\(0,1\) \(0,1\) \(0,1\) / mol
\(\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
help me