Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

Giả sử: M số proton và nơtron lần lượt là p và n
=> Khối lượng nguyên tử của M: mp.p+mn.n
X có số p và n lần lượt là p và n
=> Khối lượng nguyên tử của X là: mp.p +mn.n
( mp và mn lần lượt là khối lượng của 1 hạt proton và 1 hạt nơtron)
Mà mp =mn = 1,67.10^-27 nên
Khối lượng nguyên tử của M: mp.( n+p)
Khối lượng nguyên tử của X : mp.(n + p )
(+++: Vì khối lượng của 1 nguyên tử là tổng khối lượng của p, e và n, mà khối lượng của e không đáng kể nên khối lượng của nguyên tử có thể tính bằng khối lượng của p và n)
* ta có:
n-p = 4 <=> n=p+4 (1)
n =p (2)
p+ xp = 58 => xp = 58 - p (3)
* Hợp chất A có công thức MX(x) trong đó M chiếm 46,67% về khối lượng nên:
M / (M+xX) = 46,67/100 <=> [mp.(n+p)] / [mp.(n+p) + x.mp.(n +p )] = 46,67/100
<=> (n+p) / [(n+p) +x(n +p )] = 46,67/100 (4)
Thay (1), (2), (3) vào (4) ta giải ra được : p = 26 => Kim loại M chính là Fe
p=26 => n= 26 +4 = 30 và xp = 32
Với x=1 => p =32 => phi kim là Ge (loại )
Với x=2 => p =16 => phi kim là S( thuộc chu kì 3 nên thỏa mãn điều kiên=> chọn)
Vậy công thức của hợp chất A là: FeS2

X tạo bởi chất ion với clo có công thức là XC1, vậy X là kim loại có hoá trị I.
Y cùng số nhóm với X vậy cũng có hoá trị I, công thức clorua của nó là YC1.
Ta có:
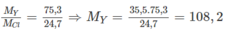
( M Y và M Cl lần lượt là NTK của nguyên tố Y và nguyên tố clo). Đó là Ag. Nguyên tố X cùng chu kì, cùng số thứ tự nhóm với Ag là kali (K))

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!
A và B cùng thuộc một nhóm trong bảng tuần hoàn và A có 6 electron ở lớp ngoài cùng, vậy A là Oxy (O) và B là Lưu huỳnh (S). Hợp chất của A với Hydrogen có phần trăm khối lượng Hydrogen bằng 5,88% nên hợp chất đó là nước (H2O).
B tạo với X (nhóm VIIA) một hợp chất XzB trong đó chiếm 81,61% khối lượng. Vì B là Lưu huỳnh (S) và X thuộc nhóm VIIA nên X có thể là Flo (F), Clo (Cl), Brom (Br), Iot (I) hoặc Astatin (At). Tuy nhiên, chỉ có Clo (Cl) tạo ra hợp chất với Lưu huỳnh (S) có phần trăm khối lượng là 81,61% (hợp chất đó là SCl2).
Phân tử XY có tổng diện tích hạt nhân là 26 và X và Y cùng một chu kì ở hai nhóm liên tiếp. Vậy X có thể là Nhôm (Al) và Y là Silic (Si) vì tổng số hạt nhân của chúng là 26 và chúng cùng thuộc chu kì 3 trong bảng tuần hoàn. Vậy công thức phân tử là AlSi.