Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Thế điện cực và nguồn điện hóa học (phần 2) SVIP

Lưu ý: Ở điểm dừng, nếu không thấy nút nộp bài, bạn hãy kéo thanh trượt xuống dưới.
Bạn phải xem đến hết Video thì mới được lưu thời gian xem.
Để đảm bảo tốc độ truyền video, OLM lưu trữ video trên youtube. Do vậy phụ huynh tạm thời không chặn youtube để con có thể xem được bài giảng.
Nội dung này là Video có điểm dừng: Xem video kết hợp với trả lời câu hỏi.
Nếu câu hỏi nào bị trả lời sai, bạn sẽ phải trả lời lại dạng bài đó đến khi nào đúng mới qua được điểm dừng.
Bạn không được phép tua video qua một điểm dừng chưa hoàn thành.
Dữ liệu luyện tập chỉ được lưu khi bạn qua mỗi điểm dừng.
1. Pin điện hóa là thiết bị chuyển hóa năng lượng của phản ứng oxi hóa – khử thành dòng điện.
2. Pin galvani là pin điện hóa có cấu tạo gồm hai điện cực, mỗi điện cực ứng với một cặp oxi hóa – khử và thường nối với nhau qua cầu muối.
3. Khi pin điện hóa hoạt động: ở anode (cực âm) xảy ra quá trình oxi hóa; ở cathode (cực dương) xảy ra quá trình khử.
4. Sức điện động chuẩn của pin bằng thế điện cực chuẩn của cathode trừ thế điện cực chuẩn của anode:
\(E^o_{pin}=E^o_{cathode}-E^o_{anode}\)
5. Các loại pin khác như acquy, pin nhiên liệu, pin Mặt Trời,... hiện được sử dụng rộng rãi trong đời sống và sản xuất.
Một pin galvani được thiết lập ở điều kiện chuẩn theo sơ đồ sau:
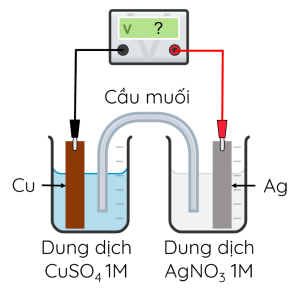
Kí hiệu của pin điện hóa trên là
Hoàn thành các phản ứng xảy ra ở mỗi điện cực và phản ứng xảy ra trong pin.
- Ở anode: .
- Ở cathode: .
- Phản ứng xảy ra trong pin:
2 + → 2 + .
(Kéo thả hoặc click vào để điền)
Biết thế điện cực của của các cặp oxi hóa - khử Cu2+/Cu và Ag+/Ag lần lượt là +0,340 V và +0,799 V. Sức điện động chuẩn của pin là
Trong pin điện hóa, quá trình oxi hóa
Trong quá trình hoạt động của pin Cu – Ag, phản ứng xảy ra trong pin là
Trong một pin điện hóa xảy ra phản ứng sau: Fe + Cu2+ → Cu + Fe2+.
(Nhấp vào ô màu vàng để chọn đúng / sai)| a) Tính oxi hóa của Cu2+ yếu hơn Fe2+. |
|
| b) Thanh Cu là cực dương và xảy ra quá trình khử. |
|
| c) Các electron chuyển từ thanh Fe sang thanh Cu qua cầu muối. |
|
| d) Trong quá trình pin hoạt động, khối lượng thanh Cu giảm dần. |
|
Thiết lập pin Sn – Cu ở điều kiện chuẩn. Biết thế điện cực chuẩn của các cặp oxi hóa – khử Sn2+/Sn và Cu2+/Cu lần lượt là -0,137 V và +0,340 V. Sức điện động chuẩn của pin là bao nhiêu (làm tròn kết quả đến chữ số hàng phần trăm).
Trả lời: .
Văn bản dưới đây là được tạo ra tự động từ nhận diện giọng nói trong video nên có thể có lỗi
- cô Thân ái chào mừng các em đã quay trở
- lại với khóa học Hóa Học lớp 12 tại
- olm.vn ở bài học trước các em đã được
- học về thế điện cực chuẩn và ý nghĩa bài
- học hôm nay sẽ nối tiếp với một nội dung
- cũng có liên quan đến thế điện cực chuẩn
- là nguồn điện hóa
- học bài học gồm hai nội dung chính là
- pin ganvani và một số nguồn điện
- khác đầu tiên về pin
- ganvani khi các phản ứng oxy hóa khử xảy
- ra luôn đi kèm theo sử chuyển
- electron trong trường hợp các quá trình
- oxy hóa và quá trình khử xảy ra trên các
- điện cực khác nhau và electron được
- truyền qua dây dẫn thì năng lượng hóa
- học được chuyển thành năng lượng
- điện thiết bị thực hiện được sự chuyển
- hóa này được gọi là PIN điện hóa
- như vậy pin điện hóa là thiết bị chuyển
- năng lượng của phản ứng oxy hóa khử
- thành dòng
- điện chẳng hạn đối với phản ứng cu2 + C
- Zn tạo thành cu C zn2 + chúng ta có thể
- thiết kế hai thí nghiệm như
- sau thí nghiệm 1 Nhúng thanh kẽm vào
- dung dịch
- CuSO4 lúc này đồng sinh ra bám lên trên
- thanh kẽm nên trong trường hợp này không
- thể thiết lập được pin điện
- hóa thí nghiệm thứ hai Nhúng thanh kẽm
- vào dung dịch znso4 thanh đồng vào dung
- dịch
- CuSO4 như vậy chúng ta đã tạo được hai
- điện cực kẽm và đồng như tìm hiểu ở bài
- học trước dùng dây dẫn nối hai điện cực
- này với một bóng đèn nhỏ kh thấy bóng
- đèn
- sáng Nguyên nhân là do trong trường hợp
- này chúng ta đã thiết lập được một pin
- điện hóa chuyện năng lượng hóa học thành
- dòng điện nên làm cho bóng đèn
- sáng pin điện hóa được thiết lập như thí
- nghiệm hai được gọi là p
- ganvani pin ganvani là PIN điện hóa gồm
- hai điện cực trong đó mỗi điện cực ứng
- với một cặp oxy hóa khử và chúng thường
- được nối với nhau thông qua Cầu Muối pin
- ganvani ở điều kiện chuẩn được thiết lập
- như sau ở 25° c Nhúng một thanh kim loại
- a vào cốc đựng dung dịch am c Nhúng một
- thanh kim loại B vào cốc đựng dung dịch
- BN C nối Thanh A và thanh B bằng dây dẫn
- lm 1 vô kế để đo hiệu điện thế đóng kín
- mạch bằng một Cầu
- Muối pin này được ký hiệu là PIN AB B
- Trong đó a có tính khử mạnh hơn
- b trong pin ganv điển cực kim loại a có
- tính khử mạnh hơn đóng vai trò là cực âm
- enod là nguồn cung cấp electron do tại
- đây xảy ra quá trình oxy hóa A thành am
- c cộng
- me các electron được tạo ra theo giấy
- dẫn di chuyển sang điện cực B có tính
- khử yếu hơn Tại đây xảy ra quá trình khử
- BN c c ne tạo thành B điện cực b là nơi
- nhận electron nên đóng vai trò là cực
- dương cat
- thốt các quá trình oxy hóa và khử xảy ra
- trên các điện cực đồng nghĩa với việc
- trong pin xảy ra phản ứng oxy hóa khử BN
- c c a tạo thành am + c
- b trong quá trình pin hoạt động câu muối
- cho phép các ion di chuyển qua do đó vừa
- đóng kín mạch điện Vừa Duy trì tính
- trung hòa điện của mỗi dung
- dịch giá trị thu được trên vô kế được
- gọi là sức điện động chuẩn của pin Ký
- hiệu là e0 PIN xác định dựa vào thế điện
- cực chuẩn của các cặp oxy hóa khử ứng
- với hai điện cực cụ thể e0 pin bằng e0
- catod trừ e0
- anod chúng ta xét một ví dụ cụ thể như
- sau thết lập pin znc ở điều kiện chuẩn
- Đằng cách Nhúng thanh Zn vào dung dịch
- znso4 Thanh cu vào dung dịch
- CuSO4 nối thanh Zn và Cu bằng dây dẫn
- lắp vô kế để đò hiệu điện thế đóng kín
- mạch bằng một Cầu Muối trong trường hợp
- này cácem có tính khử mạnh hơn nên đóng
- vai trò là ano tại Thanh kẽm xảy ra quá
- trình oxy hóa Zn thành zn2 C Electron
- được truyền qua dây dẫn sang điện cực
- đồng tại đây xảy ra quá trình khử CO2 +
- Thành
- cu như vậy phản ứng xảy ra trong pin là
- cu2 + + Zn tạo thành zn2 + C cu sức điện
- động chuẩn của pin được tính bằng e0 k t
- trừ e0 en tức là bằng e0 của cu2 + tr cu
- trừ e0 của zn2 + tr Zn và kết quả thu
- được là 1,102 V phù hợp với giá trị hiệu
- điện thế ghi trên vô
- kế chúng ta cùng làm thêm một ví dụ
- tương tự
- nhé một pin canv được thiết lập điều
- kiển chuẩn theo sơ đồ sau các em hãy
- quan sát sơ đồ pin để viết ký hiệu pin
- điện các quá trình xảy ra ở điện cực và
- phản ứng xảy ra trong pin sau đó tính
- sức điện động chuẩn của
- pin cho biết thế điện cực chuẩn của các
- cặp oxy hóa khử CO2 + tr Cu và Ag C tr
- Ag lần lượt là Dương 0,340 V và Dương
- 0,79 V
- Xin chúc mừng các em đã có câu trả lời
- chính xác Quan sát sơ đồ pin điện ta
- thấy pin điện hóa này được tạo thành từ
- hai điện cực đồng và điện cực bạc ứng
- với hai cặp oxy hóa khử là cu2 + tr Cu
- và Ag C trên
- Ag trong đó đồng có tín khử mạnh hơn nên
- đóng vai trò là anod còn bạc đóng vai
- trò là
- catod do đó pin này được gọi là PIN
- cuag tại enote xảy ra quá trình oxi hóa
- Đồng Thành Đồng 2 c tại catốt xảy ra quá
- trình khử bạc cộng thành bạc và phản ứng
- xảy ra trong pin là Ag c c cu tạo thành
- Ag C cu2
- + sức điện động chuẩn của pin bằng thế
- điện cực chuẩn của cat trừ thế điện cực
- chuẩn của An tức là bằng e0 Ag C tr Ag
- trừ e0 cu2 + trc bằng 0,459 v đây cũng
- chính là giá trị xuất hiện ở trên V Kế
- bên cạnh pin điện hóa thì trong đời sống
- một số loại pin khác cũng được sử dụng
- rộng rãi như ắc quy pin nhiên liệu pin
- mặt trời chúng ta cùng tìm hiểu các loại
- pin này trong phần thứ hai một số nguồn
- điện
- khác đầu tiên là nguồn điện được sử dụng
- phổ biến trong các phương tiện giao
- thông thiết bị lưu điện phát điện đó là
- Ắc quy Ắc Quy thuộc loại pin thứ cấp hay
- còn gọi là pin sạc nghĩa là các chất
- phản ứng được tái tạo trong quá trình
- sạc bằng dòng điện một chiều ác quy trì
- được sử dụng nhiều hơn cả do giá thành
- thấp dễ sản xuất hoạt động ổn định sau
- khi đã qua sử dụng thì có thể dễ dàng
- thu hồi sulfuric acid và chì để tái chế
- Tuy nhiên các quy trì thường nặng có
- tuội thọ thấp trung bình khoảng 1 năm và
- gây ra ổ nhiễm môi trường và ngộ độc chì
- ở các làng nghề tài chế Ác quý
- cũ loại Thứ hai là pin nhiên liệu đây
- cũng là PIN điện hóa chuyển đội hóa năng
- thành điện năng thông qua phản ứng oxy
- hóa khử giữa nhiên liệu như methan
- Methanol ethanol hydrogen vân vân B chân
- oxy hóa thường là
- oxygen pin nhiên liệu hydrogen oxygen có
- nhiều ứng dụng và triển vọng trong tương
- lai với các ưu điểm như điều Trịnh được
- cương độ dòng điện Nhớ thay đổi tốc độ
- dòng nhiên liệu ha hiệu suất chuyển đổi
- năng lượng cao lượng chất phát thả ít và
- dễ kiểm
- soát Đán liền với các ưu điện vượt trội
- đấy thì giá thành của pin nhiên liệu
- tương đối cao nên chưa được sử dụng rộng
- rãi cuối cùng là một loại pin năng lượng
- rất quen thuộc đối với chúng ta đó là
- pin mặt trời pin mặt trời gồm nhiều tấm
- vật liệu bán dẫn được ghép nối với nhau
- có khả năng chuyển đổi quang năng thành
- điện
- năng do đó nguồn năng lượng từ pin mặt
- trời là nguồn năng lượng sạch không phát
- thải khí gây ô nhiễm môi trường chúng ta
- tận dụng được Năng Lượng Vô Tận của mặt
- trời tuy nhiên vì mặt trời sản xuất phức
- tạp giá thành cao phụ thuộc nhiều vào
- điều kiện thời tiết khí hậu ngoài ra các
- tấm pin mặt trời khí Hết Hạn Thì có nguy
- cơ gây ô nhiễm môi
- trường như vậy chúng ta vừa đi tìm hiểu
- các nội dung cơ bản của bài học nguồn
- điện hóa học trước khi kết thúc bài học
- ngày hôm nay cô cùng các em sẽ làm một
- số bài tập để luyện tập
- nhé câu hỏi đầu tiên thuộc dạng câu hỏi
- trắc nghiệm nhiều phương án lựa
- chọn các em hãy cho biết trong biên điện
- hóa quá trình oxy hóa xảy ra ở
- đâu đáp án của các em hoàn toàn chính
- xác chúng ta đã được học ở cực âm eno
- của pin điện hóa xảy ra quá trình oxy
- hóa dạng khử thành dạng oxy
- hóa câu hỏi thứ hai trong quá trình hoạt
- động của pin cuag phản ứng xảy ra trong
- pin là phản ứng
- nào đáp án của cô là đáp án a như đã
- phân tích ở ví dụ trước trong pin cuag
- điện cực Đồng đóng vai trò là enote tại
- đây xảy ra quá trình oxy hóa C điện cực
- bạc đóng vai trò là catốt tại đây xảy ra
- quá trình khử do đó phản ứng xảy ra
- trong pin là cu C Ag c tạo thành Ag C
- cu2 +
- câu hỏi thứ ba là câu hỏi trắc nghiệm
- đúng sai cho phản ứng xảy ra trong một
- pin điện hóa như sau Fe c cu2 + tạo
- thành cu C Fe2
- + các em hãy cho biết các phát biểu dưới
- đây đúng hay
- sai Xin chúc mừng các em đã có câu trả
- lời chính xác đáp án của cô như sau từ
- phản ứng xảy ra trong pin chúng ta dễ
- dàng so sánh được tính oxy hóa của cu2 +
- và Fe2 + cụ thể là tính oxy hóa của cu2
- + mạnh hơn Fe2 + nế phát biểu a là
- sai Biên Điện hóa này có cực âm là Fe
- cực dương là cu và tại cực Dương xảy ra
- quá trình khửu cu2 + thành cu Phát biểu
- b là
- đúng phát biểu C là sai do tại cực âm
- giải phóng electron các electron này
- chuyển s cực dương cu thông qua dây dẫn
- chứ không phải thông qua Cầu
- Muối nhận định D cũng sai do trong quá
- trình pin hoạt động đồng được tạo ra và
- bám lên trên thanh đồng nên khối lượng
- thanh đồng tăng
- dần câu hỏi cuối cùng là câu hỏi trắc
- nghiệm trả lời ngắn yêu cầu các em tính
- sức điện đồng chuẩn của pin sncu được
- thiết lập ở điều kiện chuẩn Biết thế
- điện cực chuẩn của các cặp oxy hóa khử
- N2 + tr n và cu2 + trên cu lần lượt là -
- 0,137 V và Dương 0,340
- V đáp án của cô là 0,48
- V đối với pin ncu thì thiếc đóng vai trò
- là
- enot tại đây xảy ra quá trình oxy hóa
- với điện thế là - 0,137 V còn thanh đồng
- đóng vai trò là C Thố với điện thế Thế
- là Dương 0,340 V do đó sức điện động
- chuẩn của pin bằng điện thế ở catod trừ
- điện thế Ở enod làm tròn kết quả đến
- hàng phần trăm chúng ta được 0,48
- v như vậy chúng ta vừa đi tìm hiểu về
- các nội dung về nguồn điện hóa học và
- làm một số ví dụ minh họa để luyện tập
- thêm các em hãy truy cập vào trang web
- olm.vn và ấn theo dõi kênh học trực
- tuyến olm để cập nhật các bài dạng sớm
- nhất nhé Xin chào và hẹn gặp lại các em
- trong các bài học tiếp theo
Bạn có thể đăng câu hỏi về bài học này ở đây
