Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Sự ăn mòn kim loại SVIP
I. Ăn mòn kim loại
1. Khái niệm
Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim dưới tác dụng của các chất trong môi trường, trong đó kim loại bị oxi hóa.
Ví dụ:
- Thép để lâu ngoài không khí ẩm thường tạo thành gỉ sắt có màu nâu đỏ.
- Vật bằng đồng để lâu trong tự nhiên có thể tạo thành gỉ đồng màu xanh.


2. Các dạng ăn mòn kim loại trong tự nhiên
a) Ăn mòn hóa học
- Khi để kim loại trong không khí, có thể xảy ra hiện tượng ăn mòn hóa học.
- Nguyên nhân: Xảy ra phản ứng oxi hóa – khử trực tiếp giữa kim loại với các chất oxi hóa có trong môi trường.
Ví dụ: Bộ phận của thiết bị lò đốt bằng sắt bị ăn mòn bởi khí oxygen
3Fe(s) + 2O2(g) \(\underrightarrow{t^o}\) Fe3O4(s)
b) Ăn mòn điện hóa
- Sự ăn mòn điện hóa kim loại xảy ra khi có sự tạo thành pin điện.
Ví dụ: Sự ăn mòn điện hóa kim loại trong không khí ẩm.
Trong không khí ẩm, trên bề mặt của gang, thép luôn có một lớp nước mỏng đã hòa tan khí O2 và CO2 tạo thành dung dịch chất điện li. Sắt và các thành phần khác (chủ yếu là carbon) cùng tiếp xúc với dung dịch đó, tạo nên vô số pin điện hóa rất nhỏ mà cathode là sắt, anode là carbon.
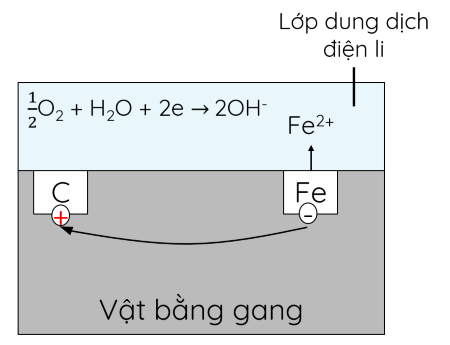
+ Ở anode, xảy ra quá trình oxi hóa:
Fe(s) → Fe2+(aq) + 2e
+ Ở cathode, xảy ra quá trình khử:
\(\dfrac{1}{2}\)O2(g) + H2O(l) + 2e → 2OH-(aq)
Fe2+ tiếp tục bị oxi hóa bởi O2 không khí, tạo thành gỉ sắt có thành phần chính là Fe2O3.nH2O.
- Điều kiện của quá trình ăn mòn điện hóa:
+ Hai điện cực khác nhau về bản chất, có thể là hai kim loại khác nhau hoặc một kim loại và một phi kim.
+ Hai điện cực tiếp xúc với nhau trực tiếp hoặc gián tiếp thông qua dây dẫn điện.
+ Hai điện cực cùng tiếp xúc với một dung dịch chất điện li.
II. Chống ăn mòn kim loại
1. Phương pháp điện hóa
Nguyên tắc: Gắn kim loại cần bảo vệ lên một kim loại khác hoạt động hóa học mạnh hơn. Khi đó, kim loại hoạt động hóa học mạnh hơn bị ăn mòn.
Ví dụ: Để bảo vệ tàu biển làm bằng thép, người ta gắn các tấm kẽm lên vỏ tàu (phần chìm dưới nước).
2. Phương pháp phủ bề mặt
- Nguyên tắc: Ngăn kim loại tiếp xúc trực tiếp với môi trường.
+ Phủ kim loại cần bảo vệ bằng các kim loại khác không gỉ như Au, Sn, Zn.
Ví dụ: Vỏ đồng hồ mạ vàng; tráng thiếc lên lá thép (sắt tây); tráng kẽm lên lá thép (tôn).
+ Phủ kim loại cần bảo vệ bằng các hợp chất vô cơ hoặc hữu cơ như sơn, dầu, mỡ,...
Ví dụ: Các đồ vật bằng sắt thường được sơn hoặc tra dầu, mỡ.
1. Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim dưới tác dụng của các chất trong môi trường.
2. Hai loại ăn mòn kim loại:
- Ăn mòn hóa học: xảy ra phản ứng oxi hóa – khử trực tiếp giữa kim loại với các chất oxi hóa có trong môi trường.
- Ăn mòn điện hóa: xảy ra khi có sự tạo thành pin điện.
3. Hai phương pháp bảo vệ kim loại:
- Phương pháp điện hóa: gắn kim loại cần bảo vệ lên một kim loại khác hoạt động hóa học mạnh hơn.
- Phương pháp phủ bề mặt: ngăn kim loại tiếp xúc trực tiếp với môi trường bằng cách phủ lên bề mặt kim loại cần bảo vệ một kim loại khác không bị gỉ hoặc các chất như sơn, dầu, mỡ,...
Bạn có thể đăng câu hỏi về bài học này ở đây
