
Khái niệm: Phản ứng một chiều là phản ứng xảy ra theo chiều xác định từ trái sang phải và không xảy ra phản ứng theo chiều ngược lại.
Ví dụ:
2KClO3 \(\xrightarrow[t^o]{MnO_2}\) 2KCl + 3O2
Khi đun nóng các tinh thể KClO3 có mặt chất xúc tác MnO2, KClO3 phân hủy thành KCl và O2. Cũng trong điều kiện đó, KCl và O2 không phản ứng được với nhau để tạo thành KClO3, nghĩa là phản ứng chỉ xảy ra một chiều từ trái sang phải.
Trong phương trình hóa học của phản ứng một chiều, người ta dùng một mũi tên để chỉ chiều của phản ứng.
Khái niệm: Là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng một điều kiện.
Ví dụ:
Cl2 + H2O ⇌ HCl + HClO
Trong phương trình hóa học của phản ứng thuận nghịch, người ta dùng hai mũi tên ngược chiều nhau thay cho một mũi tên đối với phản ứng một chiều.
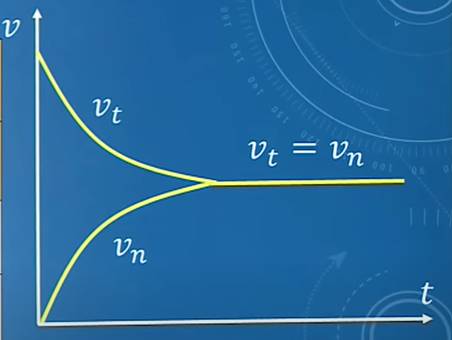
Xét phản ứng:
H2 (k) + I2 (k) ⇌ 2HI (k)
Bạn có thể đăng câu hỏi về bài học này ở đây
Học liệu này đang bị hạn chế, chỉ dành cho tài khoản VIP cá nhân, vui lòng nhấn vào đây để nâng cấp tài khoản.