Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
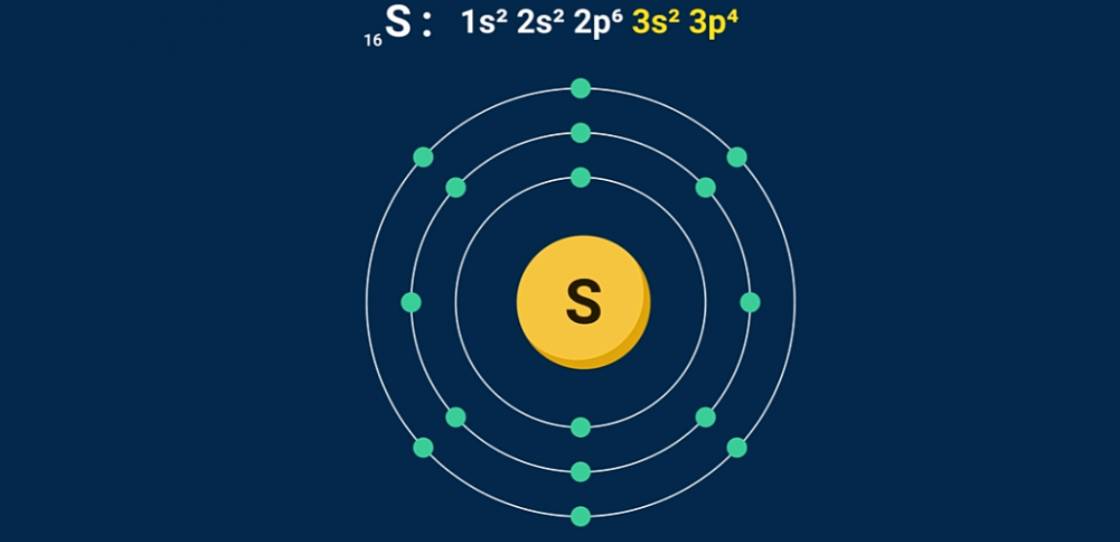
I. VỊ TRÍ, CẤU HÌNH ELECTRON NGUYÊN TỬ
- Cấu hình electron: S (Z = 16): 1s22s22p63s23p4 . Có 6 electron ở lớp ngoài cùng.
- Lưu huỳnh thuộc ô số 16, nhóm VIA, chu kì 3 của bảng tuần hoàn các nguyên tố hóa học.
II. TÍNH CHẤT VẬT LÍ
1. Hai dạng thù hình của lưu huỳnh
- Lưu huỳnh có hai dạng thù huỳnh là: Lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ). Chúng khác nhau về cấu tạo tinh thể và tính chất vật lí nhưng có tính chất hóa học giống nhau.
- Hai dạng thù hình Sα và Sβ có thể biến đổi qua lại cho nhau tùy theo điều kiện nhiệt độ.
| Lưu huỳnh tà phương (Sα) | Lưu huỳnh đơn tà (Sβ) |
|
|
| |
2. Ảnh hưởng của nhiệt độ đến tính chất vật lý
| Nhiệt độ | Trạng thái | Màu sắc | Cấu tạo phân tử | |
| < 113oC | Rắn | Vàng | S8, mạch vòng tinh thể
|  |
| 119oC | Lỏng | Vàng | S8, mạch vòng linh hoạt
|  |
| > 187oC | Quánh | Nâu đỏ | S8 vòng
|  |
> 445oC
| Khí Khí Khí | Da cam | S6 |
III. TÍNH CHẤT HÓA HỌC
Ở nhiệt độ thấp, lưu huỳnh thường kém hoạt động, nhưng khi đun nóng lưu huỳnh tác dụng được với hầu hết các nguyên tố trừ các khí hiếm, nitơ, iot vàng và platin.
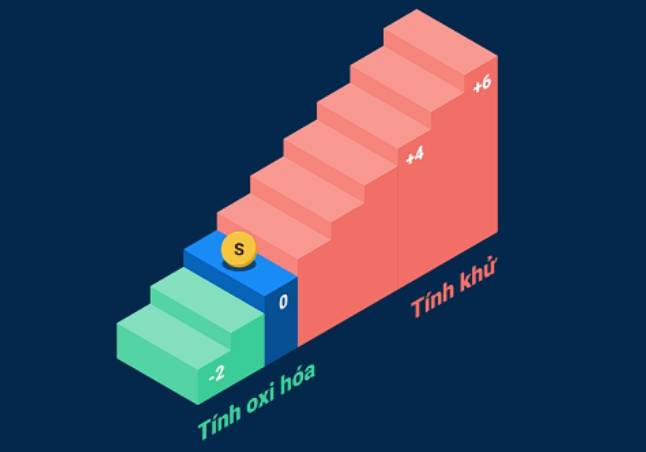
Khi lưu huỳnh tham gia phản ứng với kim loại hoặc hidro, số oxi hóa của lưu huỳnh sẽ giảm từ 0 xuống -2. Còn khi lưu huỳnh tham gia phản ứng với những phi kim hoạt động mạnh hơn như oxi, clo, flo... số oxi hóa của lưu huỳnh tăng từ 0 lên +4 hoặc +6.
Như vây, đơn chất lưu huỳnh khi tham gia phản ứng hóa học, số oxi hóa của nó có thể tăng hoặc giảm. Ta nói, lưu huỳnh có tính oxi hóa và tính khử.
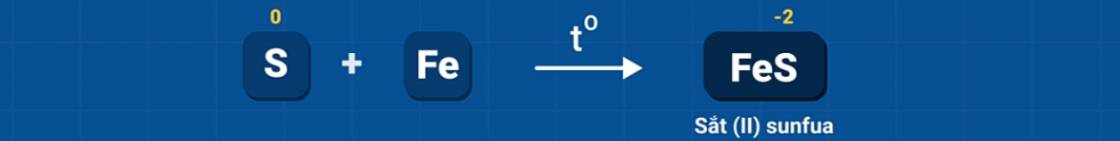
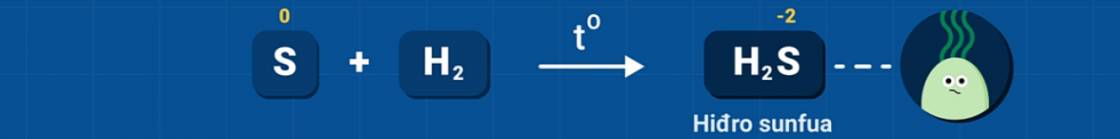
1. Tác dụng với kim loại và hidro
Ở nhiệt độ cao, lưu huỳnh tác dụng với nhiều kim loại tạo thành muối sunfua và với khí hidro tạo thành khí hidro sunfua (mùi trứng thối).
Lưu huỳnh tác dụng với thủy ngân ở nhiệt độ thường.

Vì tính chất này mà người ta thường dùng bột lưu huỳnh để xử lý thủy ngân bị thoát ra khỏi các thiết bị (nhiệt kế) khi rơi, vỡ, tránh hơi thủy ngân vô cùng độc hại gây ảnh hưởng tới sức khỏe.
Trong các phản ứng trên, S thể hiện tính oxi hóa (số oxi hóa giảm từ 0 xuống -2).
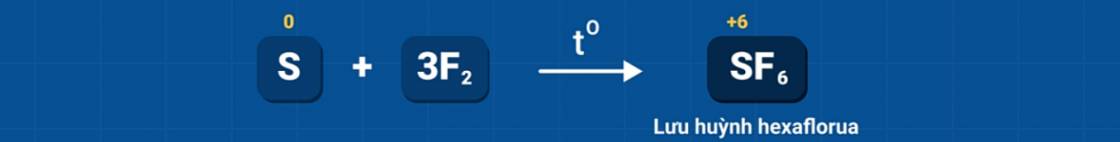
2. Tác dụng với phi kim
Ở nhiệt độ thích hợp, lưu huỳnh tác dụng với một số phi kim mạnh hơn nó như flo, oxi, clo...

.gif)
Lưu huỳnh cháy trong oxi cho ngọn lửa màu xanh lam.
Trong các phản ứng trên, S thể hiện tính khử (số oxi tăng từ 0 lên +4, +6).
IV. ỨNG DỤNG
- 90% lượng lưu huỳnh khai thác được dùng để sản xuất axit H2SO4.
- 10% còn lại dùng để lưu hóa cao su, sản xuất chất tẩy trắng bột giấy, diêm, chất dẻo, dược phẩm, phẩm nhuộm, thuốc trừ sâu, diệt nấm trong nông nghiệp.

V. TRẠNG THÁI TỰ NHIÊN VÀ SẢN XUẤT LƯU HUỲNH
- Trong tự nhiên, lưu huỳnh có nhiều ở dạng đơn chất, tạo thành những mỏ lớn. Ngoài ra, lưu huỳnh còn có ở dạng hợp chất trong cái loại quặng như quặng pirit sắt FeS2...
- Để khai thác lưu huỳnh, người ta dùng thiết bị đặc biệt để nén nước siêu nóng ở 170oC vào mỏ làm lưu huỳnh nóng chảy và đẩy lên mặt đất. Sau đó, lưu huỳnh được tách ra khỏi các tạp chất.

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây