Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. Bằng cách nào tìm được khối lượng chất tham gia và sản phẩm?
Cơ sở khoa học để sản xuất các chất hóa học trong công nghiệp hoặc điều chế một chất hóa học nào đó trong phòng thí nghiệm đó là phương trình hóa học. Dựa vào phương trình hóa học, người ta có thể tìm được khối lượng chất tham gia để điều chế một khối lượng sản phẩm nhất định hoặc với một khối lượng một chất tham gia nhất định, sẽ biết điều được một khối lượng sản phẩm là bao nhiêu.
Ví dụ 1: Nung nóng đá vôi, ta thu được vôi sống và khí cacbonic theo phương trình hóa học sau:
CaCO3 \(\underrightarrow{t^o}\) CaO + CO2
Tính khối lượng vôi sống CaO thu được khi ta nung 50 gam CaCO3.
Các bước tiến hành:
- Tìm số mol CaCO3 phản ứng:
n\(CaCO_3\) = \(\dfrac{m_{CaCO_3}}{M_{CaCO_3}}\) = \(\dfrac{50}{100}\) = 0,5 mol
- Tìm số mol CaO thu được sau khi nung:
| CaCO3 \(\underrightarrow{t^o}\) CaO + CO2 | ||
| Theo phương trình hóa học | 1 mol ➜ 1 mol | |
| Theo đề bài | 0,5 mol ➜ 0,5 mol | |
- Tìm khối lượng vôi sống CaO thu được:
mCaO = n x MCaO = 0,5 x 56 = 28 gam

Ví dụ 2: Tìm khối lượng CaCO3 cần dùng để điều chế được 42 gam CaO.
Các bước tiến hành:
- Viết phương trình hóa học để điều chế CaO từ CaCO3.
CaCO3 \(\underrightarrow{t^o}\) CaO + CO2
- Tìm số mol CaO sinh ra sau phản ứng:
nCaO = \(\dfrac{m_{CaO}}{M_{CaO}}\) = \(\dfrac{42}{56}\) = 0,75 mol
- Tìm số mol CaCO3 tham gia phản ứng
| CaCO3 \(\underrightarrow{t^o}\) CaO + CO2 | ||
| Theo phương trình hóa học | 1 mol ← 1 mol | |
| Theo đề bài | 0,75 mol ← 0,75 mol | |
- Tìm số lượng CaCO3 cần dùng:
m\(CaCO_3\) = n x M\(CaCO_3\) = 0,75 x 100 = 75 gam
.gif)
II. Bằng cách nào có thể tìm được thể tích chất khí tham gia và sản phẩm?
Dựa vào phương trình hóa học người ta có thể tính được thể tích chất khí tham gia hoặc sản phẩm trong một phản ứng hóa học.
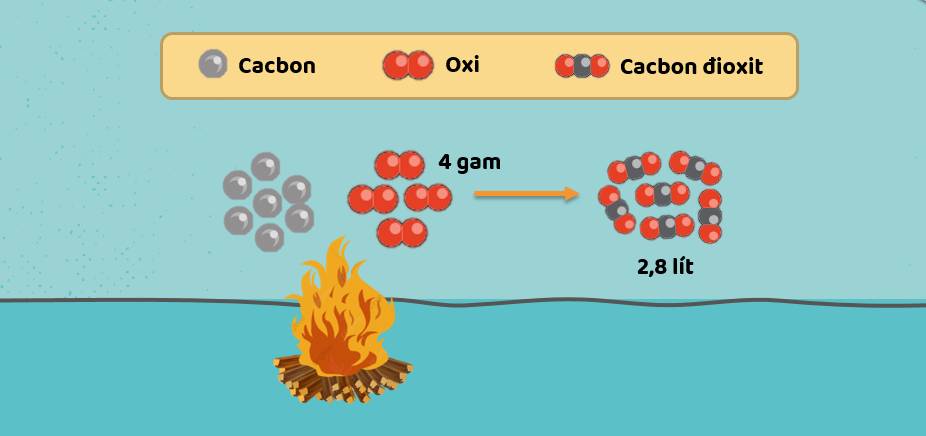
Ví dụ 1: Cacbon cháy trong oxi hoặc trong không khí sinh ra khí cacbon đioxit:
C + O2 \(\underrightarrow{t^o}\) CO2
Tìm thể tích khí cacbon đioxit CO2 (đktc) sinh ra, nếu có 4 gam khí oxi tham gia phản ứng.
Các bước tiến hành:
- Tìm số mol oxi tham gia phản ứng:
n\(O_2\) = \(\dfrac{4}{32}\) = 0,125 mol
- Tìm số mol CO2 sinh ra sau phản ứng:
| C + O2 \(\underrightarrow{t^o}\) CO2 | ||
| Theo phương trình hóa học | 1 mol ➜ 1 mol | |
| Theo đề bài | 0,125 mol ➜ 0,125 mol | |
- Tìm thể tích khí CO2 (đktc) sinh ra sau phản ứng:
V\(CO_2\) = 22,4 x n = 22,4 x 0,125 = 2,8 lít
Ví dụ 2: Tìm thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 24 gam cacbon.
Các bước tiến hành:
- Viết phương trình hóa học của cacbon cháy trong oxi:
C + O2 \(\underrightarrow{t^o}\) CO2
- Tìm số mol C tham gia phản ứng:
nC = \(\dfrac{24}{12}\) = 2 mol
- Tìm số mol O2 tham gia phản ứng:
| C + O2 \(\underrightarrow{t^o}\) CO2 | ||
| Theo phương trình hóa học | 1 mol ➜ 1 mol | |
| Theo đề bài | 2 mol ➜ 2 mol | |
- Tìm thể tích khí oxi cần dùng ở đktc:
V\(O_2\) = 22,4 x n = 22,4 x 2 = 44,8 lít.
III. TỔNG KẾT
Các bước tiến hành để tìm khối lượng hay thể tích của chất tham gia hoặc sản phẩm.
- Viết phương tỉnh hóa học .
- Chuyển đổi khối lượng chất hoặc thể tích chất khí thành số mol chất .
- Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành.
- Chuyển đổi số mol chất thành khối lượng dựa vào công thức m = n.M hoặc thành thể tích theo công thức V = n x 22,4.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây
