Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Phản ứng oxi hoá - khử và ứng dụng trong cuộc sống SVIP
I. SỐ OXI HOÁ
1. Tìm hiểu về số oxi hoá
- Số oxi hoá là một đại lượng quan trọng trong việc nghiên cứu các phản ứng có sự chuyển dịch electron, là điện tích giả định của nguyên tử nguyên tố trong hợp chất.
Số oxi hoá của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
- Quy ước viết số oxi hoá
+ Dạng đại số, dấu viết trước, số viết sau.
+ Số oxi hoá được đặt ở phía trên kí hiệu của nguyên tố.
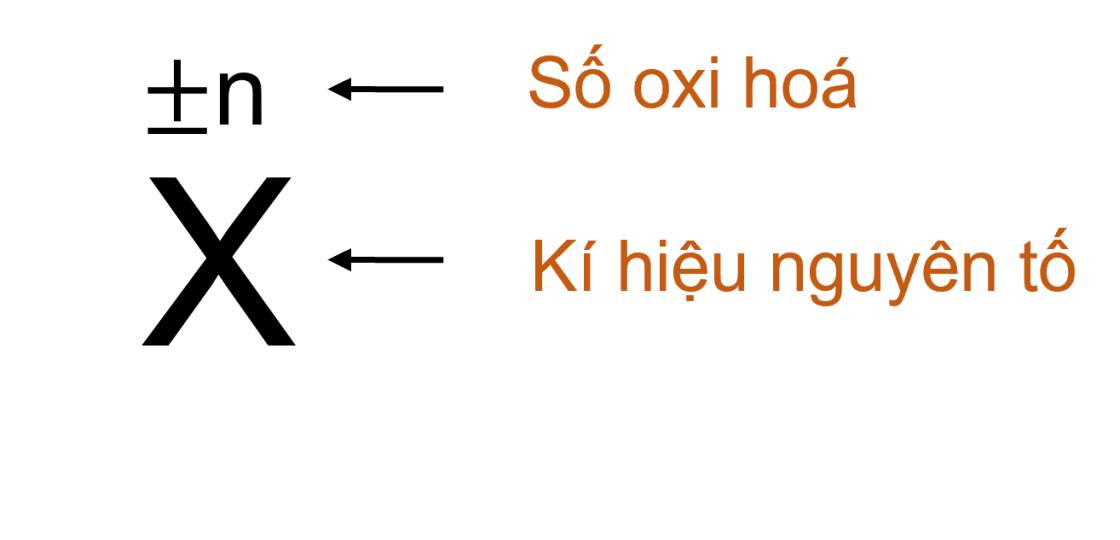
Ví dụ:

2. Quy tắc xác định số oxi hoá
Quy tắc 1: Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
Quy tắc 2: Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
Quy tắc 3: Trong các ion, số oxi hoá của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hoá các nguyên tử (đối với ion đa nguyên tử) bằng điện tích ion đó.
Ví dụ:
- Ion Na+ có điện tích là 1+, nên số oxi hoá của ion Na+ là +1.
- Ion Cl- có điện tích là 1-, nên số oxi hoá của ion Cl- là -1.
- Ion \(\left[NH_4\right]^+\) có điện tích là 1+, nên tổng số oxi hoá của các nguyên tử trong ion \(\left[NH_4\right]^+\) là +1.
Quy tắc 4: Trong đa số các hợp chất
- Số oxi hoá của hydrogen bằng +1, trừ các hydride kim loại (như NaH, CaH2,...).
- Số oxi hoá của oxygen bằng -2, trừ OF2 và các peroxide, superoxide (như H2O2, Na2O2, KO2,...)
- Kim loại kiềm (nhóm IA) luôn có số oxi hoá +1, kim loại kiềm thổ (nhóm IIA) có số oxi hoá +2. Nhôm (aluminium) có số oxi hoá +3.
- Số oxi hoá của nguyên tử nguyên tố fluorine trong các hợp chất bằng -1.

II. PHẢN ỨNG OXI HOÁ - KHỬ
1. Tiến hành thí nghiệm nghiên cứu về phản ứng oxi hoá - khử
Thí nghiệm: Zinc tác dụng với H2SO4.

- Phản ứng hoá học:
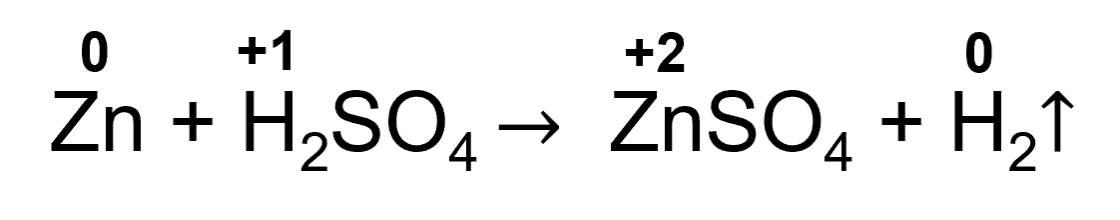
+ Trước phản ứng, số oxi hoá của Zn là 0. Sau phản ứng, số oxi hoá của Zn là +2. Chứng tỏ Zn đã nhường 2 electron. Zn là chất khử.
Quá trình Zn nhường 2 electron là quá trình oxi hoá:
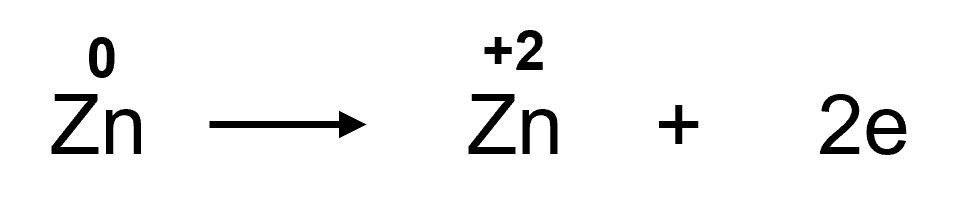
+ Trước phản ứng, số oxi hoá của ion H+ là +1. Sau phản ứng, số oxi hoá của H2 là 0. Chứng tỏ ion H+ đã nhận 2 electron. H+ là chất oxi hoá.
Quá trình H+ nhận electron gọi là quá trình khử:
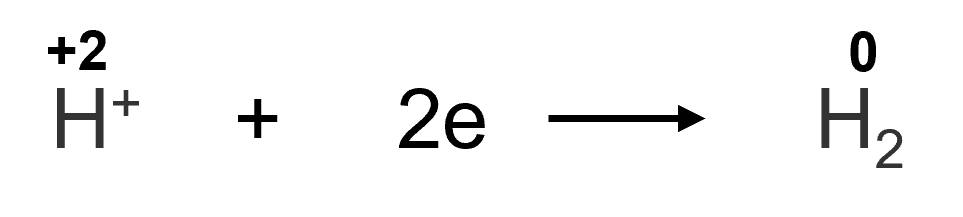
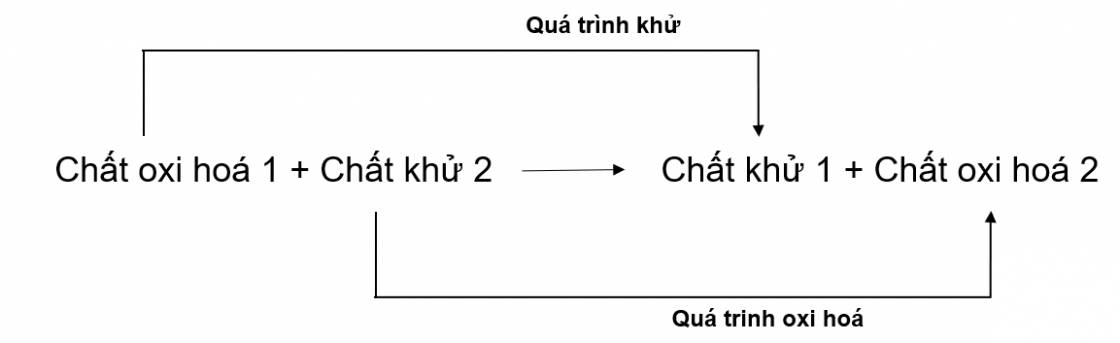
Chất khử (Chất bị oxi hoá): Chất nhường electron, số oxi hoá tăng sau phản ứng. Quá trình chất khử nhường electron là quá trình oxi hoá.
Chất oxi hoá (Chất bị khử): Chất nhận electron, số oxi hoá giảm sau phản ứng. Quá trình chất oxi hoá nhận electron là quá trình khử.
III. LẬP PHƯƠNG TRÌNH HOÁ HỌC CỦA PHẢN ỨNG OXI HOÁ – KHỬ
Phương pháp thăng bằng electron
Tổng số electron chất khử nhường = Tổng số electron chất oxi hoá nhận.
Ví dụ:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá, chất khử.
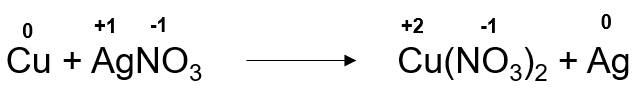
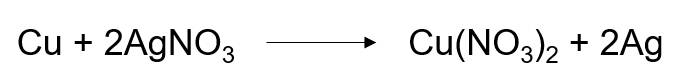
Ta có phản ứng sau:
- Nhận xét:
+ Nguyên tử Cu trước phản ứng có số oxi hoá là 0, sau phản ứng có số oxi hoá +2. Ta thấy số oxi hoá của Cu sau phản ứng tăng ⇒ Cu là chất khử.
+ Nguyên tử Ag trong phân tử AgNO3 trước phản ứng có số oxi hoá là +1, sau phản ứng có số oxi hoá là 0. Ta thấy số oxi hoá của Ag giảm sau phản ứng ⇒ AgNO3 là chất oxi hoá.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
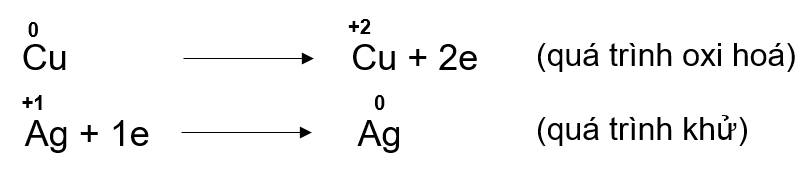
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hoá nhận.
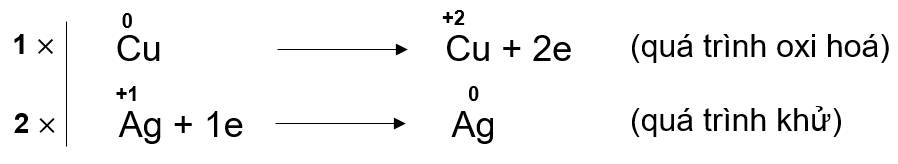
Bước 4: Đặt hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
IV. Ý NGHĨA CỦA PHẢN ỨNG OXI HOÁ - KHỬ
1. Tìm hiểu về sự cháy của nhiên liệu
- Gas: Nhiên liệu trong nấu nướng
+ Thành phần chính là hỗn hợp propane (C3H8) và butane (C4H10).
+ Gas cháy trong không khí, xảy ra phản ứng oxi hoá - khử. Phản ứng này toả nhiệt lớn và lượng nhiệt này thường được dùng để nấu chín thức ăn.

Đốt cháy khí butane trong khí gas, PTHH: 2C4H10 + 13O2 → 8CO2 + 10H2O
- Hỗn hợp nổ H2 và O2: Kích nổ nhiên liệu cho những chiếc tàu con thoi
+ Hỗn hợp khí hydrogen và oxygen là hỗn hợp gây ra phản ứng nổ, trong đó hydrogen là chất khử và oxygen là chất oxi hoá. Phản ứng tạo sản phẩm là H2O và giải phóng năng lượng rất lớn, dùng làm kích nổ hỗn hợp nhiên liệu của các tàu con thoi.
2H2 + O2 \(\underrightarrow{t^o}\) 2H2O

2. Mô tả một số phản ứng oxi hoá - khử quan trọng gắn liền với cuộc sống
- Quang hợp ở thực vật: Điều kiện xảy ra phản ứng là có ánh sáng mặt trời và có sắc tố quang

6CO2 + 6H2O → C6H12O6 + 6O2
- Luyện kim: Ứng dụng trong luyện chromium, gang thép, nhôm (aluminium),...
Sản xuất gang: 3CO(g) + 2Fe2O3(s) \(\underrightarrow{t^o}\) 4Fe(m) + 3CO2(g)
- Điện hoá: Các quá trình oxi hoá - khử xảy ra có sự tham gia của dòng điện hoặc phát sinh dòng điện.
Ứng dụng: mạ điện, mạ nhúng nóng; hoạt động pin - ắc quy, điện phân,...
Các em đã học:
1. Số oxi hoá là điện tích quy ước của nguyên tử và được tính theo các quy tắc xác định số oxi hoá.
2. Chất khử là chất nhường electron, chất oxi hoá là chất nhận electron.
3. Bản chất của phản ứng oxi hoá khử:
4. Nguyên tắc lập phương trình hoá học của phản ứng oxi hoá - khử theo phương pháp thăng bằng electron:
Σ số electron chất khử nhường = Σ số electron chất oxi hoá nhận
5. Các phản ứng oxi hoá - khử xảy ra phổ biến trong thực tiễn: sự cháy của nhiên liệu, quá trình quang hợp ở thực vật, luyện kim, điện hoá,...
Bạn có thể đăng câu hỏi về bài học này ở đây