Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Liên kết cộng hoá trị SVIP
I. Sự hình thành liên kết cộng hoá trị
-
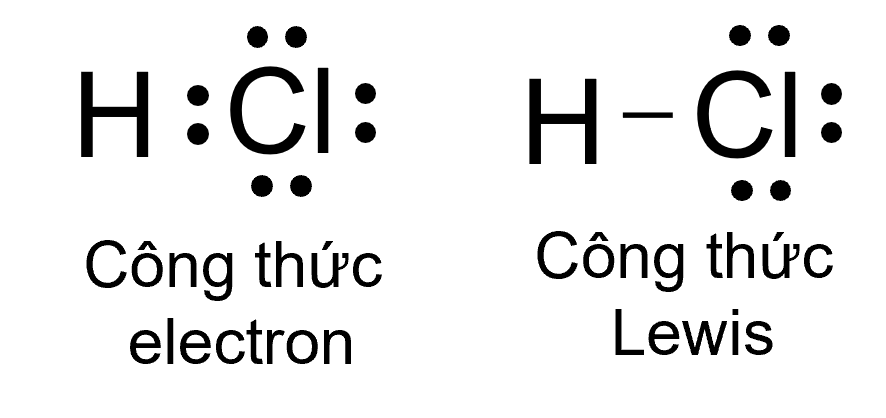
Sự hình thành liên kết trong phân tử HCl

Giữa nguyên tử hydrogen và nguyên tử chlorine trong phân tử HCl có một cặp electron chung, được biểu diễn bằng một gạch nối “\(-\)”, đó là liên kết đơn.
⇒ Do đó liên kết trong phân tử HCl được biểu diễn là H \(- \ \)Cl.
-
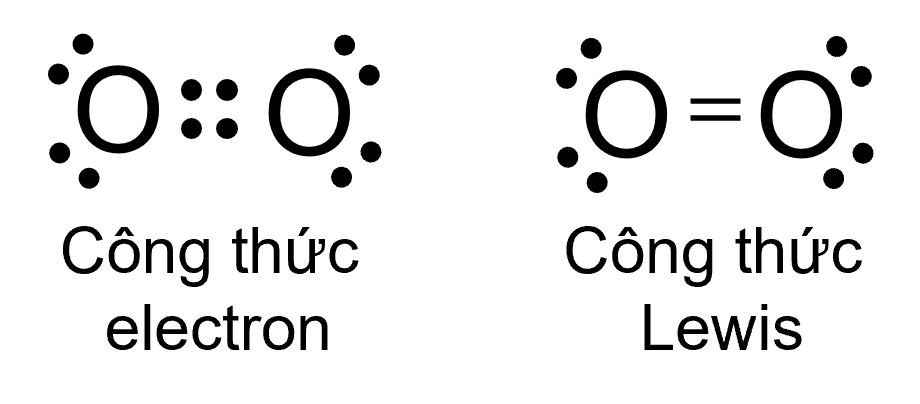
Sự hình thành liên kết trong phân tử O2

Giữa hai nguyên tử trong phân tử O2 có hai cặp electron chung, được biểu diễn bằng hai gạch nối “\(=\)”, đó là liên kết đôi.
⇒ Do đó liên kết trong phân tử O2 được biểu diễn là O \(= \ \)O.
-
Sự hình thành liên kết trong phân tử N2
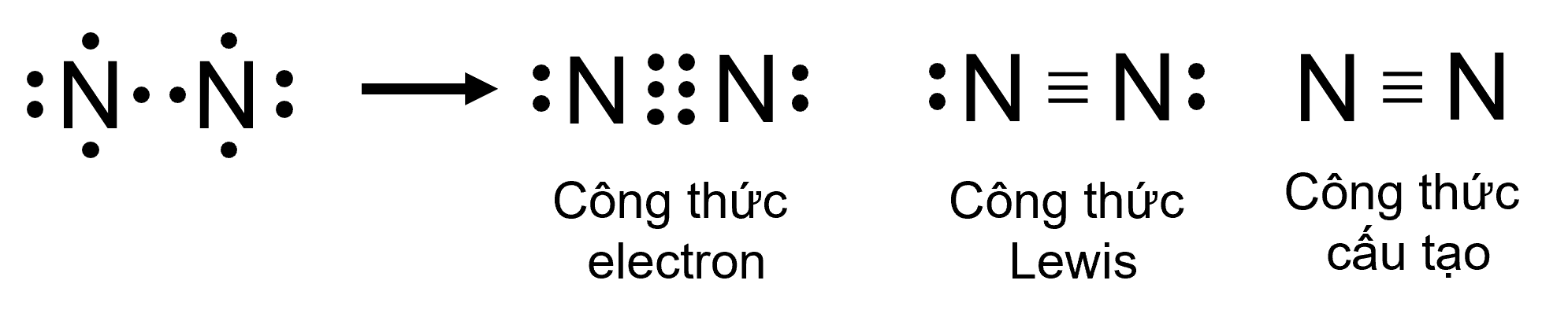
- Giữa hai nguyên tử nitrogen trong phân tử N2 có ba cặp electron chung, được biểu diễn bằng ba gạch nối “\(\equiv\)”, đó là liên kết ba.
⇒ Do đó liên kết trong phân tử N2 được biểu diễn là N \(\equiv\) N.
Liên kết cộng hoá trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron.
-
Tìm hiểu cách viết công thức Lewis
- Công thức Lewis biểu diễn sự hình thành liên kết hoá học giữa các nguyên tử trong một phân tử.
- Cách viết công thức Lewis: Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng gạch nối “\(-\)”.

Liên kết cộng hoá trị thường được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện.
II. Liên kết cho – nhận
Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hoá trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
-
Sự hình thành liên kết cho - nhận trong ion ammonium
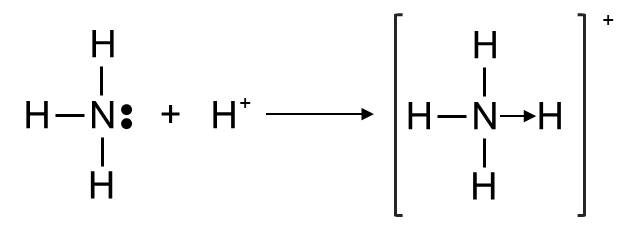
- Trên nguyên tử N của NH3 còn một cặp electron chưa tham gia liên kết. Khi NH3 kết hợp với ion H+ để hình thành ion \(NH_4^+\), cặp electron này được dùng chung giữa N và H+, vậy là sau khi hình thành liên kết, N có 8 electron lớp ngoài cùng, H có 2 electron lớp ngoài cùng, thoả mãn quy tắc octet.
- Vì cặp electron dùng chung chỉ do nguyên tử N đóng góp nên liên kết giữa N và ion H+ là liên kết cho nhận, kí hiệu là →, xuất phát từ N vì N là nguyên tử đóng góp electron.
⇒ Do đó liên kết trong ion ammonium được biểu diễn là N → H .
III. Phân biệt các loại liên kết dựa theo độ âm điện
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tham gia hình thành liên kết hoá học.
Liên kết cộng hoá trị không phân cực là liên kết cộng hoá trị trong đó cặp electron chung không lệch về phía của nguyên tử nào.
Liên kết cộng hoá trị phân cực là liên kết cộng hoá trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
- Người ta có thể dựa vào hiệu độ âm điện giữa hai nguyên tử tham gia liên kết để dựa đoán loại liên kết giữa chúng.
- 0 ≤ Δχ < 0,4: Liên kết cộng hoá trị không cực.
- 0,4 ≤ Δχ < 1,7: Liên kết cộng hoá trị có cực.
- Δχ > 1,7: Liên kết ion.
IV. Sự hình thành liên kết \(\sigma,\pi\) và năng lượng liên kết
Liên kết \(\sigma\) là loại liên kết cộng hoá trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử
- Các loại xen phủ trục:
- Xen phủ trục s - s
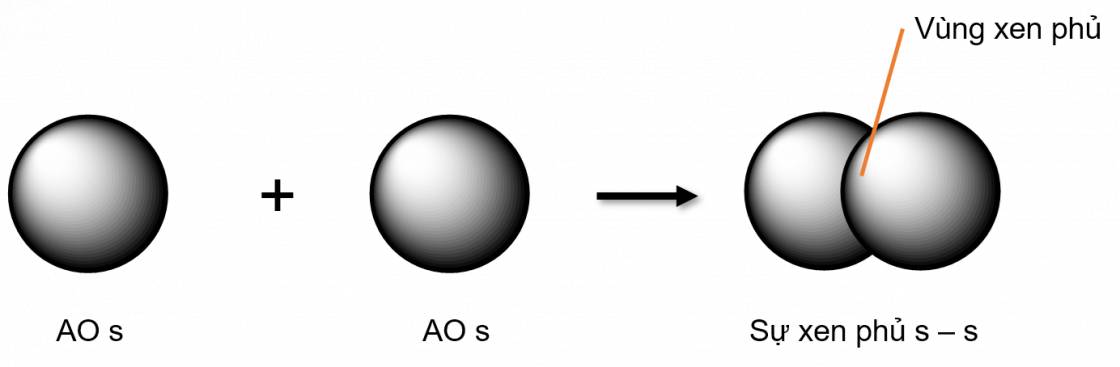
- Xen phủ trục s - p
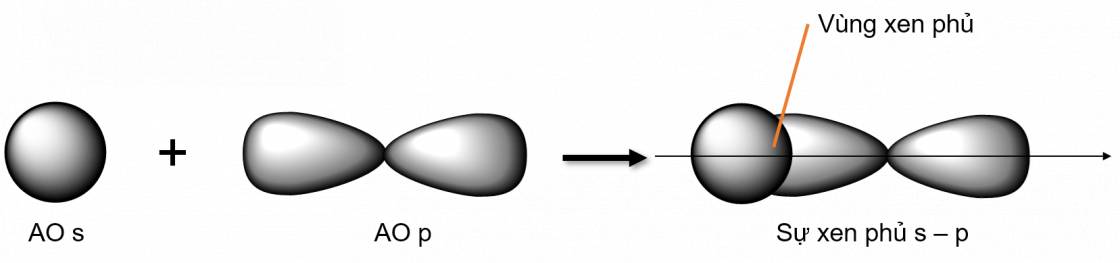
- Xen phủ trục p - p
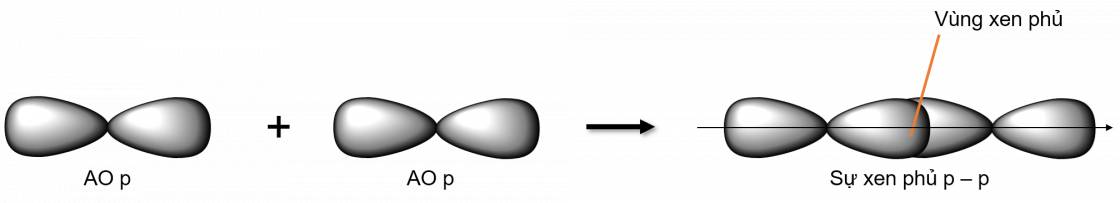
Liên kết \(\pi\) là loại liên kết cộng hoá trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
- Xen phủ bên p - p
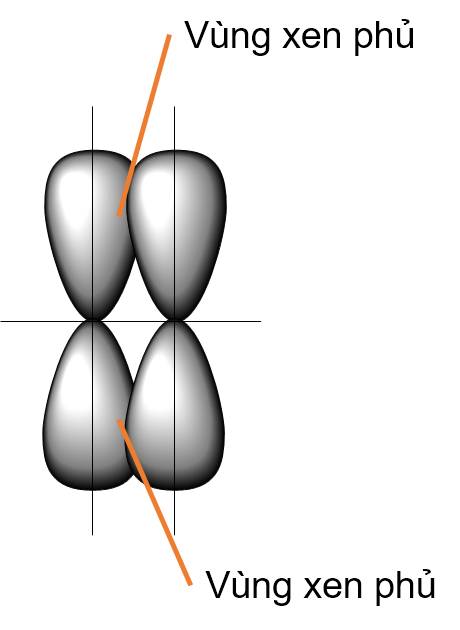
Năng lượng liên kết là năng lượng đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và ngược lại.
Trong phân tử nhiều nguyên tử, tổng năng lượng liên kết trong phân tử bằng năng lượng cần cung cấp để phá vỡ hoàn toàn 1 mol phân tử đó ở thể khí thành các nguyên tử ở thể khí.
Các em đã học:
1. Liên kết cộng hoá trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
2. Liên kết cộng hoá trị thường được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện.
3. Liên kết cho - nhận là một trường hợp đặc biệt của liên kết cộng hoá trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
4. Liên kết cộng hoá trị không phân cực là liên kết cộng hoá trị trong đó cặp electron chung không lệch về phía nguyên tử nào.
Liên kết cộng hoá trị phân cực là liên kết cộng hoá trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
5. Liên kết σ là loại liên kết cộng hoá trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử.
Liên kết π là loại liên kết cộng hoá trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
6. Năng lượng của một liên kết hoá học là năng lượng cần thiết để phá vỡ 1 mol liên kết ở thể khí, tạo thành các nguyên tử ở thể khí.
Giá trị năng lượng của một liên kết hoá học là thước đo độ bền liên kết.
Bạn có thể đăng câu hỏi về bài học này ở đây
