Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Điện phân SVIP
Tải đề xuống bằng file Word
1. Điện phân nóng chảy, điện phân dung dịch
Điện phân là quá trình oxi hóa – khử xảy ra tại các điện cực khi có dòng điện một chiều với hiệu điện thế đủ lớn đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
Nguyên tắc điện phân nóng chảy
- Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
- Tại anode (điện cực dương): xảy ra quá trình oxi hóa ion âm.
Ví dụ 1: Sodium chloride (NaCl) nóng chảy điện li thành các ion Na+ và Cl- chuyển động tự do. Trong điện trường, các ion này sẽ di chuyển về các điện cực trái dấu. Ở một hiệu điện thế đủ lớn, trên bề mặt các điện cực xảy ra các quá trình:
+ Cực âm (cathode): Xảy ra quá trình khử ion Na+:
Na+ + e → Na
+ Cực dương (anode): Xảy ra quá trình oxi hóa Cl-:
2Cl- → Cl2 + 2e
⇒ Phương trình hóa học của phản ứng điện phân NaCl nóng chảy:
2NaCl → 2Na + Cl2
Nguyên tắc điện phân dung dịch
- Khi điện phân dung dịch, nước cũng có thể tham gia điện phân với vai trò chất khử (2H2O → O2 + 4H+ + 4e) hoặc chất oxi hóa (2H2O + 2e → H2 + 2OH-).
Thí nghiệm 1: Điện phân dung dịch CuSO4 với điện cực graphite (than chì)
- Dụng cụ: Cốc thủy tinh 250 mL, điện cực graphite, bộ đổi nguồn, dây dẫn.
- Hóa chất: Dung dịch CuSO4 0,5 M.
- Tiến hành:
+ Bước 1: Rót dung dịch CuSO4 0,5 M vào cốc thủy tinh.
+ Bước 2: Cắm hai điện cực vào cốc, nối điện cực với nguồn điện một chiều.
+ Bước 3: Điều chỉnh nguồn điện khoảng 3 V - 6 V và duy trì quá trình điện phân trong khoảng 5 phút.
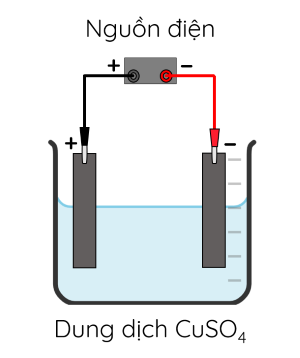
- Ở anode có thể xảy ra sự oxi hóa ion SO42- hoặc phân tử H2O. Tuy nhiên, vì H2O dễ bị oxi hóa hơn SO42- nên H2O bị oxi hóa trước, tạo thành sản phẩm là khí O2.
H2O → \(\dfrac{1}{2}\)O2 + 2H+ + 2e
- Ở cathode có thể xảy ra sự khử ion Cu2+ hoặc phân tử H2O. Vì ion Cu2+ dễ bị khử hơn H2O nên ion Cu2+ bị khử trước, tạo thành kim loại Cu bám trên cathode.
Cu2+ + 2e → Cu
- Sơ đồ điện phân:
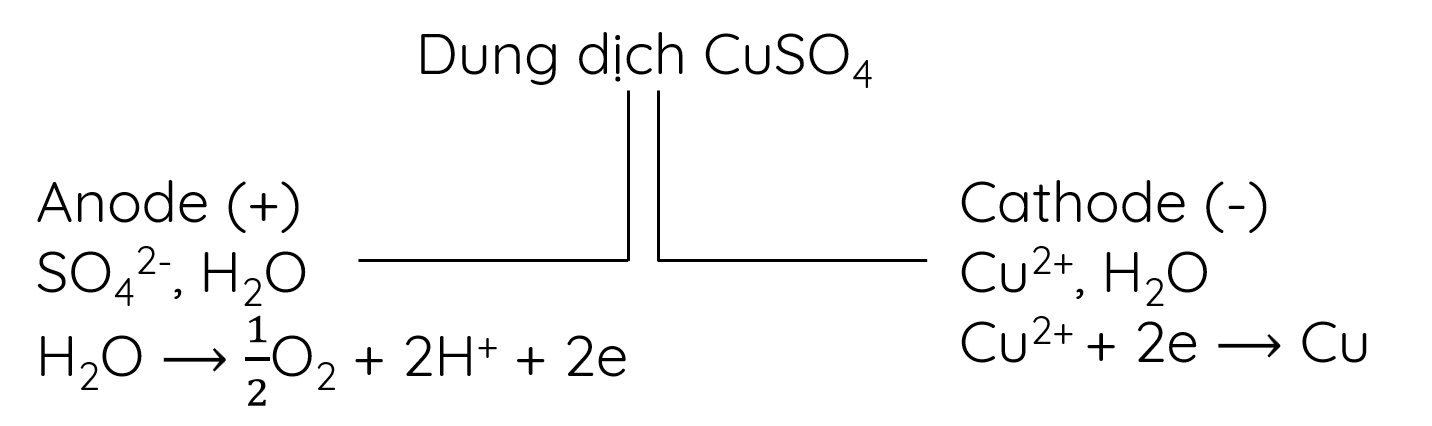
Phương trình hóa học của phản ứng điện phân:
\(CuSO_4+H_2O\overset{đpdd}{\rightarrow}Cu+\dfrac{1}{2}O_2+H_2SO_4\)
Thí nghiệm 2: Điều chế nước Javel
- Dụng cụ: Nguồn điện một chiều 3 V - 6 V, điện cực than chì, cốc thủy tinh, dây dẫn, đũa khuấy.
- Hóa chất: Muối ăn (NaCl), nước cất.
- Tiến hành:
+ Bước 1: Lấy 500 mL nước cất vào cốc thủy tinh. Sau đó lấy khoảng 150 g muối ăn và khuấy đều đến khi tan hết.
+ Bước 2: Cắm hai điện cực vào cốc thủy tinh. Nối dây dẫn vào nguồn điện một chiều và duy trì quá trình điện phân trong khoảng 5 phút.
Dung dịch thu được khi điện phân dung dịch NaCl là nước Javel, có tính tẩy màu.
Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
2. Ứng dụng
Điện phân có nhiều ứng dụng quan trọng trong thực tiễn đời sống và sản xuất.
- Phương pháp điện phân nóng chảy được sử dụng để sản xuất các kim loại mạnh (Na, Al,...).
Ví dụ 2: Kim loại Al được sản xuất trong công nghiệp bằng phương pháp điện phân nóng chảy Al2O3 với điện cực than chì khi có mặt cryolite (Na3AlF6) nóng chảy.
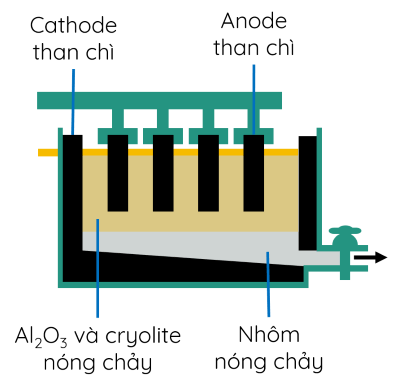
- Phương pháp điện phân với anode tan được dùng để tinh chế một số kim loại như Cu, Ag,...
Ví dụ 3: Điện phân dung dịch CuSO4 với anode bằng đồng thô và cathode bằng đồng tinh khiết.
Tại anode: Cu bị oxi hóa thành ion Cu2+ đi vào dung dịch:
Cu → Cu2+ + 2e
Tại cathode: Cu2+ bị thử thành Cu bám trên cathode:
Cu2+ + 2e → Cu
Kết thúc quá trình điện phân thu được đồng tinh khiết ở cathode.
- Phương pháp điện phân được sử dụng trong mạ điện, trong đó ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn. Anode của quá trình điện phân là các kim loại mạ thường là chromium, nickel, đồng, vàng, bạc, platinum,...và cathode là vật cần mạ.
Ví dụ 4: Mạ đồng lên một chiếc chìa khóa.
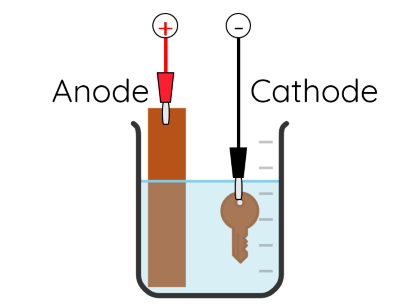
Tại anode: Cu → Cu2+ + 2e
Tại cathode: Cu2+ + 2e → Cu
1. Điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
2. Thứ tự điện phân:
- Tại anode: chất khử mạnh hơn bị oxi hóa trước.
- Tại cathode: chất oxi hóa yếu mạnh hơn bị khử trước.
3. Điện phân có nhiều ứng dụng quan trọng trong thực tiễn như: sản xuất kim loại mạnh (Na, Al,...), mạ điện, tinh chế kim loại,...
Bạn có thể đăng câu hỏi về bài học này ở đây
